您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-09-14 14:29
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
再鼎则乐补充新药上市申请获批。再鼎医药则乐(尼拉帕利)的补充上市申请获NMPA批准,用于晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌(统称为卵巢癌)成人患者对一线含铂化疗达到完全缓解或部分缓解后的维持治疗。则乐是一种口服PARP抑制剂,已于2019年12月获国家药监局批准用于维持治疗复发性卵管癌患者。则乐用于含铂化疗完全或部分缓解的复发性卵巢癌维持治疗的Ⅲ期研究NORA已取得阳性结果,完整数据将于ESMO2020大会上公布。
国内药讯
1.方盛制药「依折麦布片」首仿获批上市。9月11日,方盛制药4类仿制药依折麦布片获国家药监局批准上市,成为该品种国内首个获批的仿制药。依折麦布是是首个胆固醇吸收抑制剂,原研产品最早由先灵葆雅研发,后被默沙东收购,商品名为益适纯(Zetia/Ezetrol),用于原发性高胆固醇血症的治疗,其2019年全球销售额为5.9亿美元。目前该原研药已获批进入中国,位列国家医保乙类目录。
2.京福元奥美沙坦酯氢氯噻嗪片获批上市。北京福元4类仿制药奥美沙坦酯氢氯噻嗪片获国家局批准上市并视同通过一致性评价,成为该品种继华海药业后国内第二家上市的仿制药。奥美沙坦酯氢氯噻嗪片为固定剂量复方制剂,由第一三共制药原研,主要用于治疗高血压。目前原研产品已获批进口中国,商品名复傲坦,属于医保乙类药物。2019 年,奥美沙坦酯氢氯噻嗪片国内等级医院销售额约人民币8,321万元。
3.君实生物拓益®获FDA突破性疗法认定。君实生物PD-1特瑞普利单抗(拓益®)获FDA授予治疗鼻咽癌的突破性疗法认定。拓益是全球首个提交治疗复发/转移性鼻咽癌上市申请的抗PD-1单抗,已于2020年4月在中国递交了用于治疗既往接受过二线及以上系统治疗失败的复发/转移鼻咽癌新适应症上市申请,该申请目前已获纳入优先审评程序。此外,拓益联合化疗一线治疗鼻咽癌的Ⅲ期JUPITER-02研究(NCT03581786)已完成入组。
4.甘李药业CDK4/6抑制剂获FDA孤儿药资格。FDA授予甘李药业CDK4/6抑制剂GLR2007孤儿药资格,用于治疗包括胶质母细胞瘤(GBM)在内的恶性胶质瘤。GBM占所有原发性脑部肿瘤的52%,占所有脑部肿瘤的17%。目前临床上主要采用手术切除结合DNA甲基化剂放疗和药物化疗用于治疗脑胶质瘤,术后极易复发,患者五年生存率仍不足5%。根据GlobalData 2018年发布的预测,到2027年全球GBM 药物市场规模预计达到14 亿美元,复合年增长率达 7.5%。
5.诺华长效降脂药Inclisiran注射液获批临床。诺华PCSK9靶向siRNA药物Inclisiran注射液获国家药监局一项临床试验默示许可,用于原发性高胆固醇血症。在两项用于治疗动脉粥样硬化性心血管疾病(ASCVD)的关键III期临床(ORION-10和ORION-11)中,在随访超过17个月的患者中,Inclisiran经安慰剂校正后,99% 患者的LDL-C水平降低≥30%,较基线平均降低了54.1%;有88.4%的患者LDL-C水平至少降低了50%;其安全性和耐受性与安慰剂相似。该药目前已在美国和欧洲申报上市。
国际药讯
1.牛津-阿斯利康新冠疫苗临床试验将重启。阿斯利康在其官网上发表声明称,针对牛津-阿斯利康新冠疫苗AZD1222在Ⅲ期临床因注射疫苗的志愿者出现疑似严重不良反应而开展的独立审查已结束,根据独立安全审查委员会和英国监管机构MHRA的建议,该试验将在英国所有临床试验地点继续进行。对于该病例的相关医疗信息,阿斯利康及牛津大学疫苗团队没有作更多的透露。
2.GSK三联疗法新适应症获FDA批准。FDA批准葛兰素史克与Innoviva公司联合开发的三联疗法Trelegy Ellipta(糠酸氟替卡松/乌美铵/维兰特罗,FF/UMEC/VI)扩展适应症,用于18岁以上哮喘患者的维持治疗。在一项Ⅲ期临床试验中, Trelegy与糠酸氟替卡松/维兰特罗双联疗法相比,显著提高患者的肺功能。Trelegy Ellipta通过GSK的Ellipta干粉吸入器给药,此前已获FDA批准用于治疗慢性阻塞性肺疾病(COPD)。
3.强生提交CD38单抗新适应症上市申请。强生旗下杨森向FDA提交了CD38单抗Darzalex Faspro(daratumumab)皮下注射剂的补充上市申请,用于治疗轻链淀粉样变性患者。在一项III期临床ANDROMEDA研究中,患者分别接受daratumumab联合硼替佐米、环磷酰胺+地塞米松(D-VCd)方案,或VCd方案的治疗。结果显示,D-VCd治疗组患者的总体血液缓解率较VCd组具有明显改善,达主要终点指标。
4.赛诺菲长效凝血因子替代疗法临床结果积极。赛诺菲与Sobi联合开发的创新凝血因子VIII替代疗法BIVV001(rFVIIIFc-VWF-XTEN)在《新英格兰医学杂志》上公布其Ⅰ/Ⅱa期临床EXTEN-A的积极结果。在重度血友病A患者中,与传统凝血因子VIII(FVIII)替代疗法相比,BIVV001能够将半衰期提高3-4倍。其中在25 IU/kg剂量队列中,BIVV001单次给药的FVIII半衰期为38小时,是传统rFVIII的9小时的4倍,输注BIVV001后7天的平均因子活性水平为5%。临床中未发现过敏反应或治疗相关不良事件。
5.罗氏IL-6R单抗Enspryng公布最新研究数据。罗氏制药在MSVirtual2020会议上公布了IL-6R单抗Enspryng(satralizumab)治疗视神经脊髓炎谱系障碍的Ⅲ期临床SAkura(SakuraStar,SAkuraSky)的最新数据。事后分析显示,与安慰剂相比,Enspryng在双盲期间将严重复发的风险降低了79%(OR=0.46;95%CI:0.25-0.86,p=0.015)。与最初在安慰剂组的患者相比,Enspryng在合并的双盲期和开放标签延长期(OLE)将复发风险降低了51%(HR=0.49;95%CI:0.31-0.79;p=0.002)。此外,数据继续显示Enspryng具有良好的安全性特征。
6.武田Ninlaro多发性骨髓瘤临床失败。武田在SOHO2020 会议上公布了蛋白酶体抑制剂伊沙佐米(NINLARO™ )联合来那度胺和地塞米松用于治疗新诊断的、不适合自体干细胞移植的多发性骨髓瘤的Ⅲ期临床TOURMALINE-MM2的具体结果。与安慰剂联合来那度胺和地塞米松相比,NINLARO联合那度胺和地塞米松方案使患者的中位无进展生存期(PFS)仅增加13.5个月,两组的中位PFS分别为35.3个月和21.8个月(危险比[HR]0.830;p=0.073)。试验没有达到PFS的主要终点。
医药热点
1.国药集团新冠灭活疫苗海外平行对照零感染。国药集团中国生物负责人日前就新冠灭活疫苗紧急使用和海外Ⅲ期临床研究情况接受媒体采访时透露,国药中国生物研制的两款新冠灭活疫苗已经接种了数十万人次,无一例明显不良反应,无一人感染;其中打完疫苗之后去往海外高风险国家和地区的数万人,截至目前零感染。据悉,国药集团新冠灭活疫苗在国际上已有5亿剂意向订单。
2.接种流感疫苗应优先4类人员。中国疾控中心发布《中国流感疫苗预防接种技术指南(2020-2021)》,在新冠肺炎疫情持续全球流行的背景下,推荐四类人员为优先接种对象:医务人员,包括临床救治人员、公共卫生人员、卫生检疫人员等;养老机构、长期护理机构、福利院等人群聚集场所脆弱人群及员工;重点场所人群,如托幼机构、中小学校的教师和学生等;以及60岁及以上老年人、6月龄~5岁儿童等流感高风险人群。
3.广东:鼓励临床医务人员参与公卫服务。广东省卫健委发布《广东省2020年度国家基本公共卫生服务项目实施方案》,在国家版的基础上进行了五个方面的细化和升级:1)2020年底之前取消纸质档案;2)在公卫服务项目资金分配中建立激励机制;3)为基层疫情防控组发放临时性工作补助;4)村医公卫补助可采取按比例预拨的方式;5)鼓励临床医务人员参与公卫服务。
股市资讯
【万泰生物】公司新型冠状病毒(2019-nCoV)抗原检测试剂盒(荧光免疫层析法)获得欧盟 CE 认证的公告,可在欧盟国家和认可欧盟 CE 认证的国家销售。
【北陆药业】公司完成修改经营范围的公司变更,新增销售化工产品 (不含危险化学品及易制毒品)、原料药(钆布醇、钆喷酸葡胺、瑞格列奈),限沧州分公司经营:药用辅料(葡甲胺)、生产化工产品。
【赛升药业】收到四川大学华西医院出具的“注射用纤溶酶治疗急性缺血性脑卒中上市后有效性和安全性的随机、盲法、安慰剂平行对照、多中心临床试验”的伦理委员会审查批件,结论为同意。
审评动向
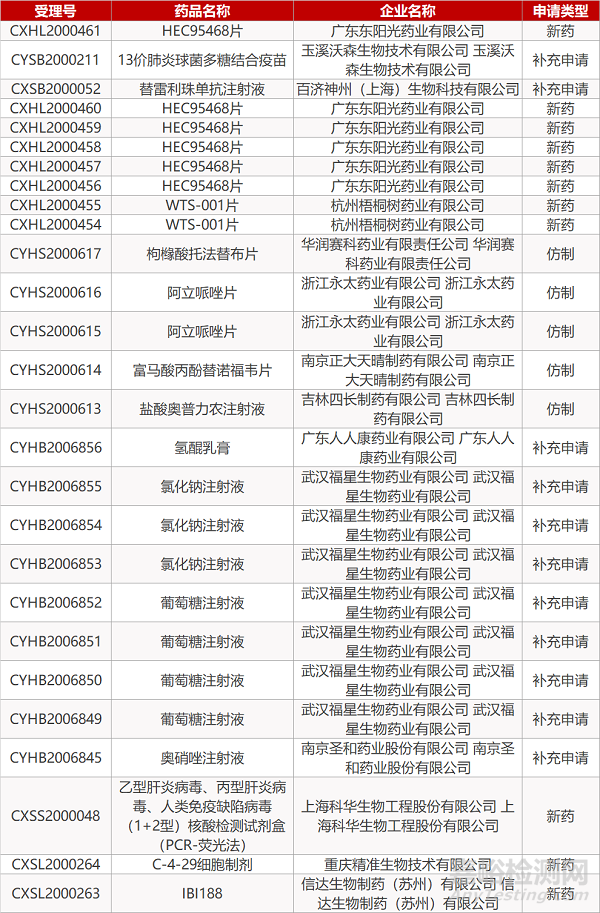
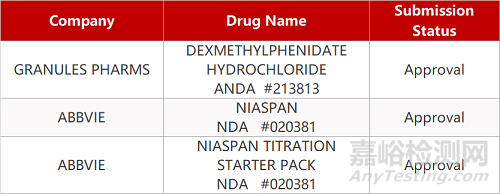
1. CDE最新受理情况(09月13日)
- The End -

来源:药研发


