您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-10-12 10:29
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
康方生物PD-1/CTLA-4双抗拟纳入突破性疗法认定。康方生物PD-1/CTLA-4双抗AK104 获CDE拟纳入突破性疗法认定公示名单,适应症为既往含铂治疗期间或治疗后疾病进展的复发或转移性宫颈鳞癌(含腺鳞癌)。Insight数据库显示,AK104已在CDE登记并启动6项临床,在ClinicalTrails.gov登记11项临床,单药或联合用药治疗肝细胞癌、鼻咽癌、非小细胞肺癌等多种实体瘤,国内处于II期临床阶段。目前,国内同靶点双抗仅有齐鲁处于I期临床的QL1706。
国内药讯
1.人福医药盐酸拉贝洛尔片获得美国FDA批准文号。人福医药全资子公司Epic Pharma仿制药盐酸拉贝洛尔片获FDA批准上市,用于治疗各种类型高血压。根据IQVIA数据,2019年该药品在美国市场的总销售额约为5,000万美元,主要生产厂商包括PAR FORM、TEVA等。根据米内网数据,2019年度盐酸拉贝洛尔所有剂型在我国城市、县级及乡镇三大终端公立医院的销售额约为5,000万元人民币,主要生产厂商包括迪赛诺制药、灵康制药、凯利药业等。
2.赛诺菲dupilumab第2个上市申请拟纳入优先审评。赛诺菲度普利尤单抗注射液(dupilumab)上市申请获CDE纳入拟优先审评公示名单。dupilumab是一款抑制IL-4/IL-13的单抗,其2019年销售额突破20亿欧元,是赛诺菲六大核心产品之一。在中国,度普利尤单抗是临床急需境外新药之一,已在今年6月获批用于治疗成人中重度特应性皮炎。本次纳入拟优先审评的是一项新适应症,拟用于治疗12岁及以上青少年和成人中重度特应性皮炎。
3.亚盛医药又获两项FDA孤儿药资格。FDA授予亚盛医药细胞凋亡管线在研原创新药MDM2-p53抑制剂APG-115、Bcl-2/Bcl-xL抑制剂APG-1252两项孤儿药资格,分别用于治疗急性髓系白血病(AML)、小细胞肺癌(SCLC)。APG-115已在中国和美国展开多项治疗实体瘤及血液肿瘤的临床研究,这次是APG-115获得的第二项FDA孤儿药资格。APG-1252目前正在美国和澳大利亚进行针对晚期癌症的Ⅰ期剂量爬坡试验,其联合紫杉醇治疗复发难治SCLC患者已处于Ⅰb/Ⅱ期试验阶段。
4.安斯泰来ADC疗法申报临床。安斯泰来注射用enfortumab vedotin的2项临床试验申请获CDE受理。这是一款靶向Nectin-4的抗体偶联药物(ADC),曾获FDA授予突破性疗法认定和优先审评资格,已于2019年底在美国获批上市,用于治疗局部晚期或转移性尿路上皮癌患者。此次是该产品首次在中国申报临床。值得一提的是,这款药物与PD-1抑制剂pembrolizumab构成的组合疗法,也曾获FDA授予的突破性疗法认定,用于一线治疗局部晚期或转移性尿路上皮癌初治患者。
5.信达抗肿瘤新药IBI102获批临床。信达生物GITR靶向单抗IBI102获国家药监局临床试验默示许可,拟用于治疗晚期恶性肿瘤。GITR属于TNFRSF超家族的一种1型跨膜蛋白,GITR和TNFRSF家族的其他分子,都可作为共刺激受体,从而成为增强免疫治疗的潜在靶点,尤其是免疫检查点抑制剂。根据Insight数据库,目前全球范围内已有13款靶向GITR新药,但大多处于较早期研究阶段,尚无上市产品。
国际药讯
1.NEJM发表瑞德西韦全球试验最终结果。吉利德瑞德西韦治疗COVID-19住院患者的Ⅲ期ACTT-1试验的最终报告发表在《新英格兰医学杂志》(NEJM)上。与安慰剂相比,瑞德西韦使患者恢复时间加快了29%(两组中位恢复时间:10天vs15天);将患者在第15天时获得临床症状改善的几率提高50%;将患者死亡风险降低27%,但不具统计学意义(第15天时,6.7%vs11.9%;第29天时,11.4%vs15.2%);两组严重不良事件发生率分别为24.6%和31.6%。
2.再生元中和抗体组合疗法REGN-COV2递交EUA申请。再生元宣布已向FDA递交了使用其中和抗体组合疗法REGN-COV2治疗COVID-19患者的紧急使用授权(EUA)申请。REGN-COV2是由两种靶向新冠病毒刺突蛋白受体结合域(RBD)的单抗(REGN10933和REGN10987)组成,通过与RBD的不同表位结合,阻止新冠病毒与细胞上的受体结合,防止病毒入侵。初步临床数据已显示在治疗非住院COVID-19患者时,能够降低患者的病毒载量和缩短症状缓解所需时间。
3.安进心衰药物omecamtiv mecarbi达Ⅲ期主要终点。安进和Cytokinetics联合研发的心衰药物omecamtiv mecarbil,在治疗患有射血分数降低的慢性心衰(HFrEF)患者的Ⅲ期Galactic-HF研究中达主要终点。相对于安慰剂,该药物使患者直到死亡或需要治疗心力衰竭的时间减少了8%,但该药物未能达到延长患者寿命的次要终点。两家公司正在进一步分析这项研究的数据,并计划下个月在美国心脏协会科学会议上展示这些数据。
4.阿斯利康长效新冠抗体组合启动III期研究。阿斯利康宣布其COVID-19长效抗体(LAAB)组合AZD7442将启动2项III期临床试验,分别为涉及6000余例受试者的预防性试验和大约4000例受试者的治疗试验。AZD7442是从SARS-CoV-2感染后的恢复期患者中提取的两种LAAB的组合,由范德比尔特大学医学中心发现,并于2020年6月授权给阿斯利康。阿斯利康采用其专有的半衰期延长技术进行了优化,延长了半衰期,使得单次给药疗效持久性达到6-12个月。
5.礼来中和抗体组合疗法达Ⅱ期终点。礼来由LY-CoV555和LY-CoV016(JS016)两款中和抗体构成的组合疗法,在治疗轻中度COVID-19患者的Ⅱ期临床BLAZE-1中获积极结果。组合疗法在第11天显著降低病毒载量(p=0.011), 达主要终点。与安慰剂相比,组合疗法在治疗第7天时显著降低病毒载量居高不下的患者比例(3.0%vs20.8%);降低与COVID-19相关的住院或急诊治疗风险(84.5%vs5.8%,0.9%,p=0.049);没有观察到与药物相关的严重不良事件。礼来计划11月向FDA递交这一组合的紧急使用授权申请。
6.MSD二药方案一线治疗HIV Ⅱb期结果积极。默沙东在HIV Glasgow 2020年会上公布其新型NRTTI抑制剂islatravir与Pifeltro(doravirine,多拉韦林)二药方案(2DR)治疗初治HIV-1成人感染者Ⅱb期试验(NCT03272347)的96周数据。结果显示,这款2DR在维持病毒学抑制(HIV-1 RNA<50拷贝/毫升)的患者比例方面与三合一药物Delstrigo相似,并与48周结果一致。额外的96周数据显示,在2DR治疗组和Delstrigo治疗组中,病毒学失败(PDVF)的患者比例都很低,2个治疗组均无患者达到抗药性测试标准。
7.百时美施贵宝拟拓展心血管新药管线。百时美施贵宝拟以131亿美元收购心血管药物研发公司MyoKardia,获得其拟用于治疗阻塞性肥厚性心肌病的“first-in-class”药物mavacamten。目前mavacamten已取得关键性试验EXPLORER-HCM的积极数据,预计将于明年第一季度向FDA递交其新药上市申请。百时美施贵宝还计划开发mavacamten用于其他适应症,和开发MyoKardia的其他创新药物,包括两款临床阶段的danicamtiv(MYK-491)和MYK-224。
医药热点
1.青岛新增3例无症状感染者。青岛市卫健委11日通报,青岛市新增3例新冠病毒肺炎无症状感染者,其中2例系医院在对普通就诊患者进行核酸检测时发现,1例系在对排查出的密切接触者进行即时核酸检测时发现。经流行病学调查,专家组初步判断,以上3例无症状感染者与市胸科医院相关联,该院部分独立区域承担着收治境外输入新冠病毒感染者的任务,具体感染源正在进一步排查中。
2.39个抗癌药、14个罕见病药要降价。为鼓励制药产业发展,降低患者用药成本,国家药监局等四部门联合发布了第二批适用增值税政策的抗癌药品和罕见病药品清单的公告。自10月1日起,清单中的抗癌药品和罕见病药品,将按照相关规定执行相关增值税政策。清单显示,抗癌药品制剂和原料药部分,涉及39个品种(包括达可替尼片、呋喹替尼胶囊、哌柏西利、奥拉帕尼等)和6个品种,罕见病药品部分,则共计有14个品种(包括特立氟胺片、诺西那生钠注射液、依库珠单抗等)。
3.38家公立医院“消失”。国家卫健委信息统计中心公布了截止2020年6月底的全国医疗卫生机构数,数据显示,全国医疗卫生机构数达101.6万个,相较于去年同期增加11164个,其中,医院增加1368个,基层医疗卫生机构增加11609个,专业公共卫生机构减少1993个。具体细分到医院,截止2020年6月底,医院3.5万个,其中,公立医院1.2万个,民营医院2.3万个,与2019年6月底比较,公立医院减少38个,民营医院增加1406个。
股市资讯
【恒瑞医药】格隆溴铵注射液收到国家药品监督管理局核准签发的《药品注册证书》。格隆溴铵注射液是一种抗胆碱能药物。公司为国内首家获批上市格隆溴铵注射液的企业,该产品累计已投入研发费用约1,489万元。
【海思科】公司全资子公司四川海思科制药有限公司于近日收到国家药品监督管理局下发的《受理通知书》、《药物临床试验批准通知书》,完成了HSK3486乳状注射液的境内生产药品注册,同意药品开展用于“全麻维持”的Ⅲ期临床试验。HSK3486是公司开发的全新的具有自主知识产权的静脉麻醉药物,拟用于手术全麻诱导、内镜诊疗的镇静/麻醉、ICU 镇静等适应症。按我国新化学药品注册分类规定,其药品注册分类为化药1类。
【普利制药】(1)公司获得国家药品监督管理局签发的注射用比伐芦定的生产批件,比伐芦定是一种直接凝血酶抑制剂,常做抗凝剂使用。(2)收到美国食品药品监督管理局签发的注射用阿奇霉素ANDA增加针剂三车间补充申请的批准通知。
审评动向
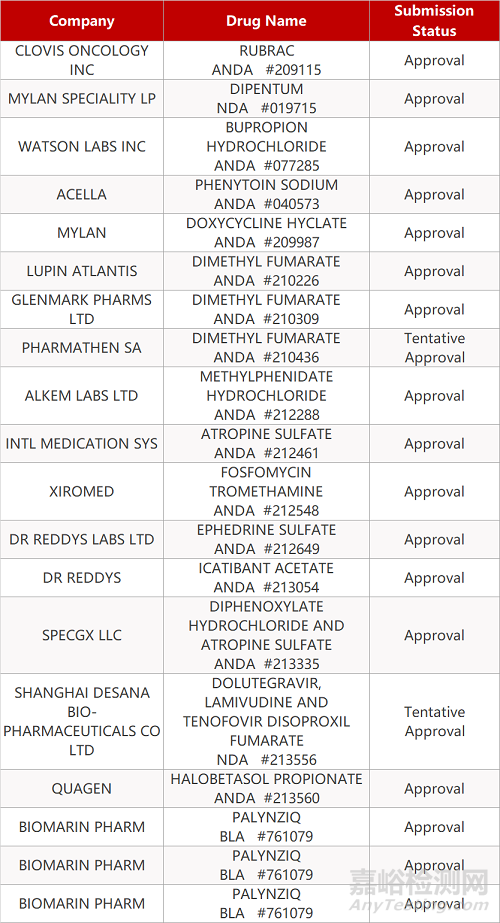
1. CDE最新受理情况(10月12日)

- The End -

来源:药研发