您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-11-03 10:27
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.正大天晴注射用艾司奥美拉唑钠首家过评。正大天晴注射用艾司奥美拉唑钠获NMPA批准通过一致性评价,为该品种首家通过一致性评价的注射剂。艾司奥美拉唑是奥美拉唑的单一左旋异构体,属于质子泵抑制剂,由阿斯利康原研,用于治疗胃食管反流性疾病、糜烂性反流性食管炎等。2019年中国公立医疗机构终端注射用艾司奥美拉唑钠的销售额已超过30亿元,其中原研产品占据 51.48%的市场份额,而在获得批文的30余家国内企业中,正大天晴和奥赛康分别以34%和11%的市场份额领先。
2.华纳大药厂枸橼酸铋钾胶囊首家通过一致性评价。湖南华纳大药厂「枸橼酸铋钾胶囊」获国家药监局批准通过一致性评价,为该品种首家通过一致性评价的仿制药。枸橼酸铋钾胶囊用于慢性胃炎及缓解胃酸过多引起的胃痛、胃灼热感(烧心)和反酸,Insight数据库显示,目前共有23家企业需要开展一致性评价,只有湖南华纳大药厂递交一致性评价补充申请并首家通过一致性评价。
3.诺诚健华奥布替尼在美获批临床。诺诚健华奥布替尼临床试验申请获FDA批准,即将在美国开展用于治疗多发性硬化症(MS)的II期临床。这是一项国际多中心II期临床,将在美国和多个欧洲国家展开,计划招募160例患者。奥布替尼是一款高选择性的新型BTK抑制剂,用于治疗B细胞淋巴瘤及自身免疫性疾病,目前正在中国及美国进行多中心、多适应症的临床试验,研究其作为单药及联合用药的疗效和安全性。
4.微芯生物糖尿病新药获批新临床。微芯生物旗下1类新药西格列他钠片获国家药监局批准,即将在2型糖尿病患者中开展与二甲双胍联合用药的临床试验,用于经二甲双胍单药治疗疗效不佳的人群控制血糖。目前西格列他钠已登记完成至少7项临床试验,适应症均为针对糖尿病。值得一提的是,微芯生物已于2019年9月在中国提交了西格列他钠治疗2型糖尿病的新药上市申请,目前正在技术审评中。
5.礼来引进复星医药BCL-2抑制剂。复星医药控股子公司复创医药与礼来签订一项合作许可协议,授予礼来对复创医药BCL-2抑制剂FCN-338在除中国大陆、香港及澳门地区之外的全球其它区域的独家权益。此笔交易金额高达4.4亿美元。FCN-338是复创医药自主研发的一款BCL-2选择性小分子抑制剂,其用于血液系统恶性肿瘤治疗的临床申请已分别获NMPA和FDA批准,目前处于Ⅰ期临床试验准备阶段。
6.紫苑生物与捷思英达达成合作协议。紫苑生物宣布与捷思英达签署专利许可协议,从后者引进AT-0287在非肿瘤适应症领域的全球开发权益。AT-0287是由捷思英达针对新靶点自主研发设计的创新药物分子,已在临床前研究中显示出治疗银屑病的潜力。根据协议,捷思英达将获总额数千万美元的首付款和里程碑付款,以及产品的销售收入提成。
国际药讯
1.吸入用阿米卡星制剂Arikayce在欧盟获批。欧盟委员会(EC)批准Insmed公司阿米卡星脂质体吸入悬液Arikayce上市,用于治疗选择有限且无囊性纤维化的成人患者,治疗由鸟型分枝杆菌(MAC)导致的非结核分枝杆菌(NTM)肺部感染。在一项全球III期临床CONVERT中,与标准治疗多药方案(MDR)相比,Arikayce联合MDR可显著提高痰培养转化率(p<0.0001),两组NTM肺病证据消除的患者比例分别为29%和9%。Arikayce是目前唯一获批治疗MAC肺部疾病的药物。
2.诺华P-选择素抑制剂Adakveo获欧盟批准。欧盟委员会(EC)批准诺华抗P-选择素单抗药物Adakveo(crizanlizumab)上市,用于年龄≥16岁的镰状细胞病(SCD)成人和儿科患者,预防复发性血管阻塞性危象(VOC)或疼痛危象。Adakveo可作为羟基脲(HU/HC)的附加疗法,也可作为单药疗法用于HU/HC不适合或应答不足的患者。在一项II期SUSTAIN临床中,在联用或不联用羟基脲疗法时,与安慰剂相比,Adakveo将VOC中位年发病率显著降低了45.3%(1.63vs2.98,p=0.010)。无论SCD基因型或羟基脲使用如何,均观察到VOC频率的显著降低。
3.肾癌一线治疗Opdivo+Cabometyx组合在日申请上市。Exelixis公司合作伙伴(武田制药和小野制药)已在日本提交了Cabometyx(卡博替尼)的一份补充申请,Cabometyx联合PD-1疗法Opdivo(纳武利尤单抗)用于治疗不可切除性、晚期或转移性肾细胞癌(RCC)患者。在一项关键III期临床CheckMate-9ER中,与Sutent(舒尼替尼)相比,Opdivo+Cabometyx将患者的无进展生存期增加一倍(中位PFS:16.6个月vs8.3个月;p<0.0001);将死亡风险显著降低40%(p=0.0010),两组的中位OS均未达到。这一组合治疗晚期RCC的补充申请刚获FDA的优先审查。
4.AVROBIO基因疗法AVR-RD-01获欧盟孤儿药资格。欧盟委员会(EC)授予AVROBIO公司基因疗法AVR-RD-01孤儿药资格,用于治疗一种罕见的X连锁遗传性疾病法布里病。AVR-RD-01是一种体外慢病毒基因疗法,患者自身的造血干细胞在经过携带正常GLA基因的慢病毒载体转导后,可表达α-Gal A,从而发挥治疗作用。AVR-RD-01此前已获FDA授予的孤儿药资格,其一项Ⅱ期临床试验正在进行中。
5.阿斯利康出售两款心血管药物。阿斯利康拟以4亿美元的价格将两款心血管药物Atacand(坎地沙坦酯)和Atacand Plus(坎地沙坦酯氢氯噻嗪片)的商业权利出售给德国Cheplapharm Arzneimittel GmbH公司,这两种药物分别被批准用于治疗心力衰竭和高血压。根据协议,阿斯利康将继续生产和供应Atacand和Atacand plus,并将在三年的过渡期内继续将这种药物商业化。Cheplapharm将在今年第四季度完成交易时向阿斯利康先期支付2.5亿美元,其余的1.5亿美元将在2021年上半年支付。
6.诺华建立首个亚洲CAR-T生产设施。日本监管机构批准诺华位于神户的生物医学研究与创新中心商业化生产其重磅CAR-T疗法Kymriah。据悉,这也是亚洲首个面向市场生产这款下一代抗癌疗法的工厂。Kymriah是全球首款CAR-T疗法,已获批用于治疗复发/难治性B细胞急性淋巴细胞白血病(ALL)和B细胞淋巴瘤。根据一份声明,诺华还计划在澳大利亚的Cell Therapies公司和位于中国的西比曼生物科技集团生产这种疗法。
医药热点
1.上海新规:患者如逃避隔离,费用自负。10月27日,上海市十五届人大常委会第二十六次会议表决通过了《上海市公共卫生应急管理条例》,条例自11月1日起正式实施。《条例》规定在呼吸道传染病流行期间,进入公共场所应佩戴口罩。对有隐瞒病史、疫情高风险地区旅行史或居住史,逃避隔离治疗、医学观察、健康观察等行为的患者,其个人负担的医疗费用不予财政补助。
2.河北2020年底前将取消医保个人(家庭)账户。10月30日,河北省政府新闻办召开“河北省全面推进基本医疗保险全民参保计划”新闻发布会。为强化门诊共济保障,河北省2020年底前,将全面取消医保个人(家庭)账户,建立门诊统筹制度,重点用于解决参保城乡居民门诊多发病、常见病;持续巩固住院待遇水平,在政策范围内住院费用医保支付比例达到70%;大病支付比例提高到60%。
股市资讯
【寿仙谷】公司及全资子公司金华寿仙谷药业有限公司获颁发明专利证书,发明名称“一种快速提取铁皮石斛多糖的方法”。
【力生制药】公司2mg规格的药品盐酸苯海索片通过仿制药质量和疗效一致性评价。
【上海医药】公司控股子公司“新亚闵行”0.125g规格的药品头孢氨苄胶囊通过仿制药质量和疗效一致性评价。
审评动向
1. CDE最新受理情况(11月02日)
2. FDA最新获批情况(北美10月30日)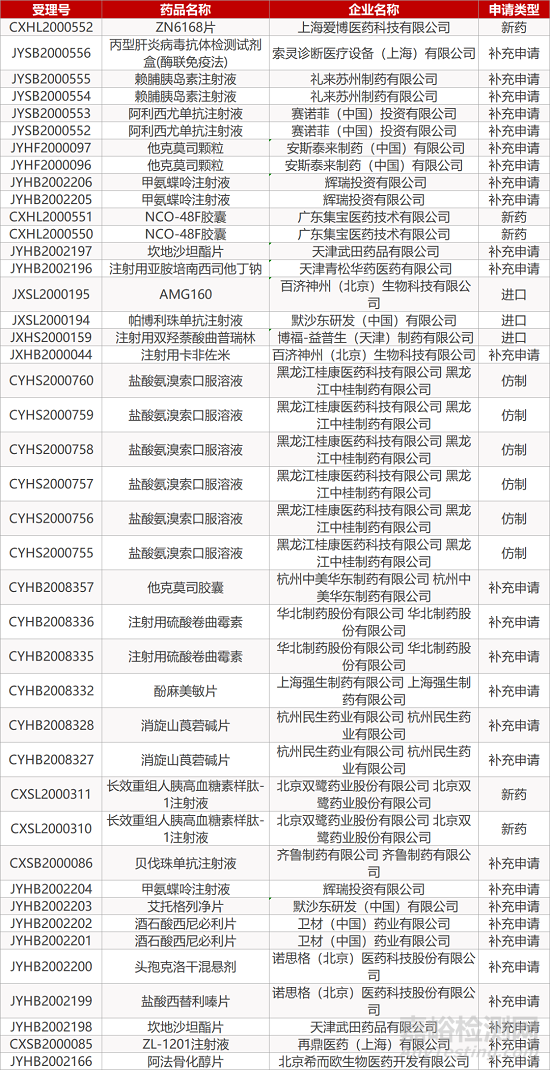
暂无
- The End -

来源:药研发


