您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-03-12 09:23
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
恒瑞阿尔兹海默病新药获批临床。恒瑞医药1类新药SHR-1707获CDE临床试验默示许可,拟开发用于治疗阿尔兹海默病(AD)。根据公开数据,该药可能为β-淀粉样蛋白(Aβ)单抗。今年2月,恒瑞在ClinicalTrials登记了一项关于SHR-1707的随机、双盲、安慰剂对照Ⅰ期临床研究,用于评估在健康年轻人和老年人中SHR-1707的单次静脉给药的安全性、耐受性、药代动力学和药效学,计划招募人数62人。
国内药讯
1.开拓药业普克鲁胺治疗新冠重症患者结果积极。开拓药业3月11日发布公告,公布普克鲁胺治疗COVID-19重症患者的临床结果。普克鲁胺于第14天达到主要终点,该治疗组基于世卫组织COVID-19等级量表评分由5.663的基线下降4.01至1.653,而对照组则由5.618的基线下降0.25至5.368(p值低于0.0001)。而且普克鲁胺降低92%患者死亡风险(3.7%对比47.6%)并缩短住院时间中位数9天(住院时间中位数5天对比14天)。
2.石药集团「尼达尼布」首仿获批上市。石药集团恩必普药业4类仿制药乙磺酸尼达尼布软胶囊获国家药监局批准上市,为该品种国内首仿。尼达尼布(Nintedanib)是一款多靶点的三重抗血管激酶抑制剂,由勃林格殷格翰原研,已获批多个适应症,包括特异性肺纤维化(IPF)、非小细胞肺癌(NSCLC)、系统性硬化病相关间质性肺疾病(SSc-ILD)和进行性纤维化性间质性肺疾病(PF-ILD)。在中国,该原研产品获批了3 个适应症( IPF、SSc-ILD和PF-ILD),商品名为维加特。
3.齐鲁制药孟鲁司特钠口溶膜首家获批。齐鲁制药2.2类新药「孟鲁司特钠口溶膜」获国家药监局批准上市,为该剂型国内首家获批。孟鲁司特钠是默沙东原研的一种强效选择性白三烯受体拮抗剂(商品名:顺尔宁),能特异性抑制气道中的半胱氨酰白三烯受体,从而起到改善气道炎症,有效控制哮喘症状的作用。该品种2019年在国内公立医疗机构的销售额接近30亿元。
4.百济神州启动HPK1抑制剂BGB-15025首次临床。百济神州在研HPK1抑制剂BGB-15025的Ⅰ期临床(NCT04649385)首例患者给药。该项临床旨在评估BGB-15025作为单药或联合PD-1百泽安®在晚期实体瘤患者中的安全性、耐受性、药物代谢动力学状况和初步抗肿瘤活性。该试验将在全球多个国家进行。HPK1是一种T细胞受体信号的关键负反馈调节物,被认为在抗肿瘤免疫反应中起到关键作用。
5.药捷安康TT-01025中美双报在美首例受试者给药在国内受理临床申报。药捷安康与韩国LGChem旗下生命科学公司(LG化学)联合宣布,合作品种TT-01025(LG0030317)在美国开展的Ⅰ期临床完成首例受试者给药。TT-01025是药捷安康开发的一款口服VAP-1抑制剂,拟用于非酒精性脂肪性肝炎(NASH)的治疗。LG化学拥有该新药除中国和日本以外的所有地区的开发、生产和商业化权利。3月11日,该新药的临床试验申请获CDE受理。
6.石药集团引入康诺亚IL-4R抗体中国区权益。3月10日,石药集团旗下津曼特生物与康诺亚生物订立协议,引进IL-4Rα单抗CM310用于呼吸系统疾病适应症(中重度哮喘和慢性阻塞性肺病等)在中国大陆独家开发及商业化权益。该产品目前在国内处于II期临床开发阶段。根据协议,康诺亚生物将获人民币7000万元首付款、1亿元开发里程碑付款,以及产品的销售分成。
7.药明康德2020年实现收入165.4亿元。药明康德日前对外发布2020年度业绩快报,2020年该公司实现收入165.4亿元,同比增长28.5%,实现归母净利润29.6亿元,同比增长59.6%,实现扣非归母净利润23.9亿元,同比增长24.6%,实现调整后non-IFRS归母净利润35.7亿元,同比增长48.1%。
国际药讯
1.新一代VEGF受体抑制剂获FDA批准上市。FDA批准AVEO Oncology 新一代VEGF受体酪氨酸激酶抑制剂(TKI)Fotivda(tivozanib)上市,用于治疗已接受过2种以上前期全身性疗法的复发/难治性晚期肾细胞癌(RCC)成年患者。在一项关键Ⅲ期临床TIVO-3中,Fotivda显著提高了这类患者的无进展生存期(5.6个月vs3.9个月,HR=0.73,95% CI: 0.56, 0.95; p=0.016),和客观缓解率(18%vs8%)。
2.礼来新冠中和抗体组合Ⅲ期临床再获佳绩。礼来(Eli Lilly)新冠中和抗体bamlanivimab(LY-CoV555,700mg)和etesevimab(LY-CoV016,1400mg)构成的组合疗法,在轻中度COVID-19非住院患者的Ⅲ期临床中获最新结果。数据显示,这一组合能将住院或死亡风险降低87%。此前,剂量为2800mg的这一组合在该项临床的另一队列中将患者住院或死亡风险降低70%。今年2月,FDA已紧急授权该组合用于治疗12岁以上进展至重度COVID-19或住院风险高的轻、中度患者。
3.膀胱癌创新疗法Vicineum申报欧洲上市。Sesen Bio公司向欧洲药品管理局提交了EpCAM 靶向抗体药物偶联物Vicineum(oportuzumab monatox,VB4-845)的营销授权申请,用于治疗高风险、对卡介苗(BCG)无应答的非肌层浸润性膀胱癌。Vicineum治疗相同适应症的生物制品许可申请在美国已进入优先审查,PDUFA目标日期为2021年8月18日。如果成功上市,该公司预计Vicineum的全球年销售峰值将达到10-30亿美元,美国市场预计为4-9亿美元。
4.吉利德新型衣壳抑制剂公布长期疗效数据。吉利德在CRIO2021年会上公布其长效HIV-1衣壳抑制剂lenacapavir(GS-6207)治疗经治的耐多药HIV-1感染者的Ⅱ/Ⅲ期CAPELLA试验的额外结果。在lenacapavir联合优化背景方案治疗下,自第一次皮下注射lenacapavir至达到第26周的受试者中,有73%(n=19/26)达到无法检测的病毒载量(<50拷贝/mL)。2019年5月,FDA已授予lenacapavir突破性药物资格(BTD),联合其他抗逆转录病毒药物,用于耐多药HIV-1感染者。
5.Vertex启动糖尿病干细胞疗法VX-880早期临床。Vertex公司宣布已在美国启动了干细胞疗法VX-880用于治疗1型糖尿病的Ⅰ/Ⅱ期临床。该项研究预计招募17例1型糖尿病患者,以评估不同剂量VX-880的安全性和有效性。VX-880临床试验将包括完全分化的功能性胰岛细胞的输注,以及长期的联合免疫抑制治疗。VX-880旨在通过恢复胰岛细胞功能(包括胰岛素的产生),来恢复机体调节血糖水平的能力。FDA已授予VX-880快速通道资格。
6.新靶点IL-36R银屑病新药一项II期研究失败。AnaptysBio抗IL-36R单抗imsidolimab治疗中重度掌跖脓疱病(PPP)的II期临床 (POPLAR)未达主要终点。Imsidolmab组和安慰剂组在第16周时患者PPPASI(掌跖脓疱银屑病区域严重程度指数)最小二乘平均差(LSMD)较基线变化值分别为6.1和6.3(p=0.93),不具统计学差异;两组患者平均PPPASI较基线分别改善38%和33%;Imsidolmab耐受性良好,不良事件发生率与安慰剂相似,未观察到严重不良事件。
医药热点
1.葛明华升任浙江省卫健委副主任。3月10日,浙江省政府官网发布公告,宣布任命葛明华担任浙江省卫生健康委员会副主任。根据公开信息,葛明华此前为浙江省人民医院院长,曾于2020年2月19日,担任浙江医疗队队长,亲自带领172名医务人员前往武汉抗疫前线, 接管中南医院新冠重症病区,3月15日又转战金银潭,接管金银潭医院重症病区。
2.林野建议专门设立临床医学研究基金。全国政协委员、北京大学口腔医院林野教授向两会建议,在科技部和自然基金委现有的生命科学研究经费里考虑医学科学的划分,每年给临床医学研究专门划出一定比例的研究经费。据统计,在2019年自然基金委8个学部所有获批的41583个项目中,医学科学部批准了10086项(占比21.1%),经费434110万元。但在这10086个项目中,医学基础研究类占99%,临床研究相关项目仅约94个(0.93%),资助费用为4733.10万元,每项平均50.35万元。
3.强生CEO去年薪酬增加420万美元。强生日前公布了2020年财务业绩,全年总收入825.84亿美元,低于董事会设定的862亿美元的运营目标。尽管强生未能实现销售和调整后每股收益的目标,但受益于该公司开发的新冠疫苗获得FDA的紧急使用授权,报告显示强生的首席执行官Alex Gorsky的2020年薪酬在2019年的基础上增加了420万美元,总计达到2958万美元。
审评动向
1. CDE新药受理情况(03月09日)
申请临床:
嘉和生物的IMSA101注射液、默沙东的帕博利珠单抗注射液、缔脉生物的KSI-301注射液(2个规格)、药捷安康的TT-01025-CL片(2个规格)、甘莱制药的ASC40片(3个规格)。
申请生产:
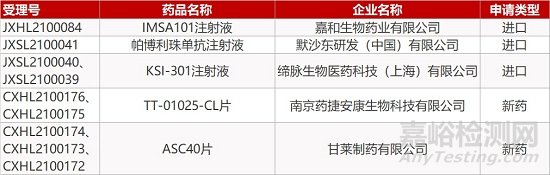
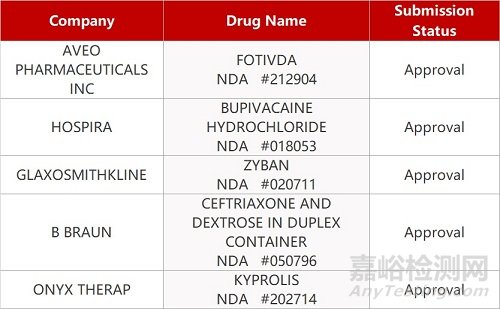
2. FDA新药获批情况(北美03月10日)
股市资讯
【复星医药】控股子公司复宏汉霖于就重组抗PD-1人源化单克隆抗体注射液联合重组抗VEGF人源化单克隆抗体注射液及化疗(XELOX)用于一线治疗转移性结直肠癌启动II/III期临床研究。
【步长制药】(1)全资子公司陕西步长获得药品GMP符合性检查结果。(2)为全资子公司步长高新在中行高新技术开发区支行发生的1,000万元借款提供连带责任保证。(3)控股子公司上海合璞取得医疗器械经营许可证。
【翰宇药业】公司的卡贝缩宫素注射液通过了一致性评价。

来源:药研发


