您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-08-05 12:10
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.普那布林治疗NSCLC国际III期临床成功。万春医药“first-in-class”GEF-H1激活剂普那布林治疗二/三线EGFR野生型晚期非小细胞肺癌患者(NSCLC)的国际Ⅲ期临床(DUBLIN-3)达到OS主要终点。与多西他赛相比,普那布林联合多西他赛在OS主要终点和多项次要终点,包括ORR、PFS、24月生存率(22.1%vs12.5%;p<0.01)、36月生存率(11.7%vs5.3%;p=0.04)、4级中性粒细胞减少症发生率(5.3%vs27.8%;p<0.0001)都具有统计学显著性的差异;其4级AE发生率也更低,未发现非预期的安全性事件。
2.九期一国际Ⅲ期临床大中华区入组。绿谷制药原研阿尔茨海默病(AD)新药甘露特钠胶囊(九期一®)国际Ⅲ期临床试验在首都医科大学宣武医院和上海市精神卫生中心分别随机入组1例患者,完成该项目大中华区首例患者给药。该项目计划在北美、欧洲和中国等14个国家和地区开展为期52周的双盲试验和26周的开放试验,涉及2046例轻中度AD患者。此次国际临床52周双盲期研究计划将在2025年全部完成。
3.恒瑞/豪森他达拉非口溶膜报NDA。恒瑞医药与豪森药业联合开发的2.2类改良新药他达拉非口溶膜的上市申请获CDE受理。他达拉非片是一种磷酸二酯酶5抑制剂,由Lilly ICOS及United Therapeutics原研,用于治疗勃起功能障碍及其合并良性前列腺增生(BPH)的症状和体征。目前该品种在国内只有普通片剂获批,尚未有其他剂型获批。齐鲁制药该品种的口溶膜制剂已首家申报上市。
4.华海TIGIT单抗HB0030获批临床。华海药业子公司华奥泰和华博生物申报的HB0030注射液临床试验申请获CDE批准,用于治疗晚期恶性实体肿瘤。HB0030是一款TIGIT靶向单抗,通过与TIGIT结合以阻断TIGIT与其配体(如CD155)的结合。TIGIT在免疫抑制性Treg细胞、CD4 +和CD8 +T细胞,以及NK细胞表面高表达,与其配体CD155结合后可产生免疫抑制。目前尚无抗TIGIT类药物上市,罗氏开发的Tiragolumab单抗进展最快,目前正处于III期临床。
5.恒瑞两款新药报IND。恒瑞两款1类创新药HRS7415和SHR-A2009的临床试验申请获CDE受理。根据代号推测,SHR-A2009是一款ADC产品,这也是恒瑞第6款申报临床的ADC药物。根据Insight数据库,除了1款恩美曲妥珠单抗生物类似药之外,恒瑞目前已申报的前两款ADC新药分别靶向c-MET、HER2,第三款ADC新药SHR-A1904推测靶向Claudin 18.2,而最新的两款SHR-A1912和SHR-A2009的靶点尚未公开。
国际药讯
1.罗氏PD-L1品种获FDA优先审评资格。FDA授予罗氏(Roche)旗下基因泰克重磅PD-L1抑制剂Tecentriq(atezolizumab)补充生物制品许可申请(sBLA)优先审评资格,用于非小细胞肺癌(NSCLC)患者手术和含铂化疗后的辅助治疗。在一项国际Ⅲ期临床IMpower010中,与标准治疗相比,Tecentriq辅助治疗将这类患者疾病复发的风险降低34%(HR=0.66,95% CI:0.50-0.88);在中位随访为32.8个月时,Tecentriq组的中位DFS尚未达到(vs35.3个月);试验中无新的安全性信号出现。
2.JAK抑制剂治疗新冠危重症最新数据积极。礼来与Incyte公司联合开发的口服JAK抑制剂baricitinib,在治疗COVID-19住院患者的Ⅲ期临床COV-BARRIER的亚组研究中获积极结果。在接受有创机械通气的COVID-19患者中,与安慰剂相比,baricitinib联合标准治疗组第28天时患者死亡风险降低了46%(HR=0.54,95% CI,0.31, 0.96),两组患者累积死亡比例为39.2%(20/51)和58%(29/50)。与在所有受试者中观察到的整体死亡率降低一致。临床中,未发现新的安全性信号。
3.安博PSMA-ADC新药上Ⅰ期临床。安博生物PSMA靶向抗体偶联药物(ADC)ARX517在Ⅰ期临床中完成首例患者给药。该项试验旨在76例既往标准治疗失败的晚期实体瘤患者中评估ARX517治疗的安全性、药代动力学、和抗肿瘤活性。之前,ARX517在对恩扎卢胺敏感性和耐药性前列腺癌临床前模型中均显示出活性,同时在毒性研究中显示出有利的PK和毒性特征。
4.IL-2靶向mRNA疗法上Ⅰ期临床。Moderna公司在研mRNA疗法mRNA-6231在Ⅰ期临床中完成首例受试者给药。该项试验将在健康成人受试者(18-50岁)中评估mRNA6231单次皮下给药的安全性、耐受性、药代动力学和药效学,计划入组112例受试者。mRNA6231编码一种与人血清蛋白融合的长效、选择性白细胞介素-2(IL-2)突变蛋白,旨在优先激活与扩增调节性T细胞。mRNA-6231也是Moderna首个进入临床的治疗自身免疫性疾病的候选药物。
5.BMS撤销Istodax治疗PTCL。百时美施贵宝(BMS)宣布从美国市场上撤回罗米地辛(Istodax)用于治疗外周T细胞淋巴瘤 (PTCL)的适应症。此前,FDA基于两项临床试验积极结果(试验评估罗米地辛对总缓解率替代终点的影响)加速批准罗米地辛用于上述适应症。然而在验证性III期临床中,与CHOP(环磷酰胺、多柔比星、长春新碱、泼尼松)相比,罗米地辛联合CHOP一线治疗PTCL 患者未达到无进展生存期的主要终点。
6.赛诺菲收购mRNA疗法公司Translate Bio。赛诺菲拟以总价约32亿美元收购Translate Bio。今年6月底,赛诺菲曾宣布每年投资约4亿欧元,建立首个mRNA疫苗卓越中心,加速新一代mRNA疫苗的端到端研发,计划4年内开发6款临床期候选产品。这一收购旨在进一步加快赛诺菲在mRNA领域的研发活动。在此前两家公司的合作中,已有两个mRNA疫苗项目(新冠疫苗和季节性流感疫苗)进入临床阶段。
医药热点
1.2021年执业药师考试报名启动。中国人事考试网发布《关于2021年度执业药师职业资格考试有关事项的通告》。根据有关文件安排,2021年度执业药师职业资格考试于10月23日、24日举行,考试形式为纸笔考试。目前2021年执业药师考试报名入口已正式开通,各省参加执业药师资格考试的考生,可以在中国人事考试网官网上报名。
2.上海确诊病例感染来源查明。上海市8月4日在新闻发布会上介绍新冠疫情防控有关情况。上海市疾控中心目前已完成8月2日上海新增本土病例的流行病学调查和基因测序工作。基因测序结果显示,该病例感染的新冠病毒属于德尔塔变异株。经比对,与近期国内多地本土病例基因组无关联,但与境外德尔塔变异株同源性较高。经专家组综合研判分析,认为该确诊病例的感染来源可以聚焦在因暴露于由境外输入病毒污染的环境引发的感染。
3.药明康德聘任陈民章博士为联席首席执行官。药明康德8月2日发布公告,聘任Minzhang Chen(陈民章)博士为联席首席执行官,陈民章将负责领导公司化学业务板块(WuXi Chemistry),整合合全药业、化学服务部、药物研发国际服务部和核心分析部等化学业务相关的资源和能力,全力推进本公司的新药研究、开发及生产服务业务新战略。
审评动向
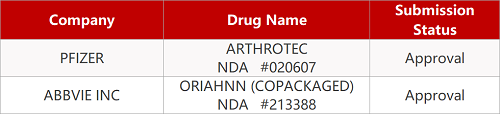
2. FDA新药获批情况(北美08月02日)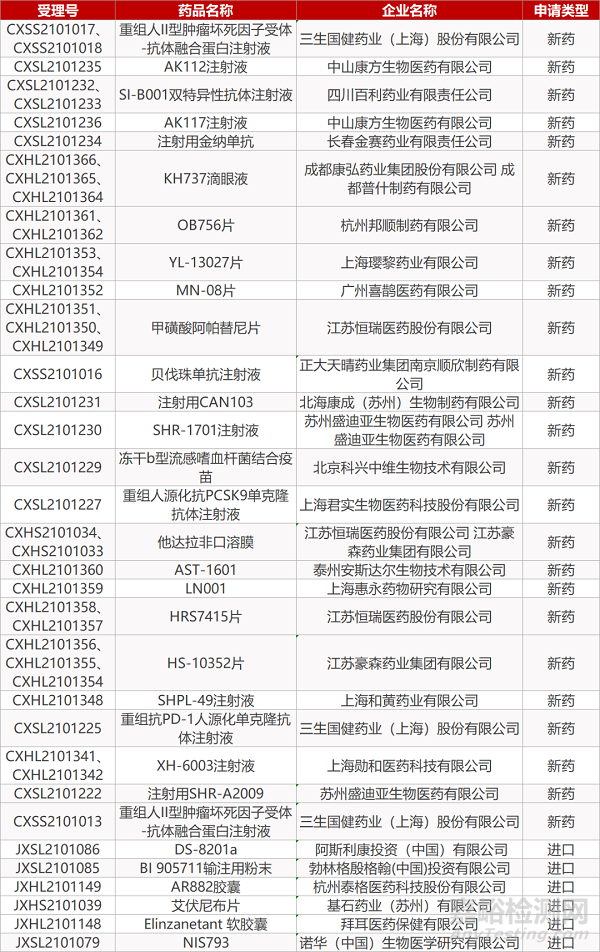

来源:药研发


