您当前的位置:检测资讯 > 监管召回
嘉峪检测网 2021-09-15 11:29
截止目前,药监局官网发布了医疗器械生产企业飞行检查情况,2021年20家、2020年51家。由于疫情原因,2020年飞行检查频率较往年有所降低,重点为医用一次性使用口罩、医用外科口罩、医用防护口罩、医用电子体温计、红外额温计等医用防护医疗器械。2021年,核查重点除防护类,还关注了无菌、植入等高风险医疗器械。
近两年飞行检查情况汇总分析如下:
飞行检查的结论
2021年,20家接受核查的医疗器械生产企业中,2家停产整改,18家限期整改(其中4家为生产防护用品的企业,在飞行检查前已处于停产状态);2020年,51家接受核查的医疗器械生产企业中,16家停产整改,35家限期整改。如图1所示
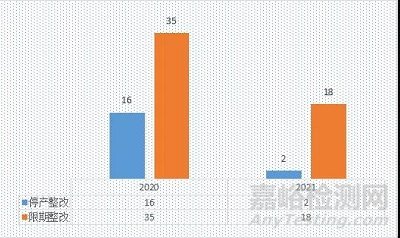
图1 飞行检查的结论分布
注:截止目前,2021年停产比例为11%,2020年停产比例为46%。
飞行检查覆盖的省市
2020-2021年飞行检查覆盖的省市分布情况,分别如图2、图3和图4所示。
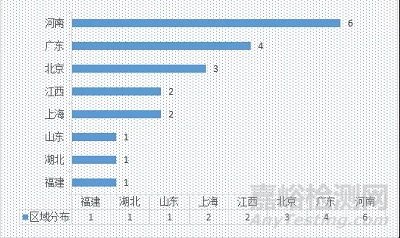
图2 2021年飞行检查覆盖省市

图3 2020年飞行检查覆盖省市

图4 2020-2021年覆盖省市的分布情况
2021年20家生产企业中,共涉及8个省市,其中河南省居多;2020年51家生产企业中,共涉及19个省市,其中广东省居多。
近两年飞行检查仍以随机抽查为主,对于医疗器械生产型企业较为密集的区域,已基本覆盖(彩色标记为飞行检查覆盖的省市)。
按照《现场检查指导原则》中11大部分,不合格条款的占比情况。
2020-2021年不合格条款占比情况,以及近两年不合格条款的对比情况,分别如图5、图6和图7所示。

图5 2021年不合格条款占比情况
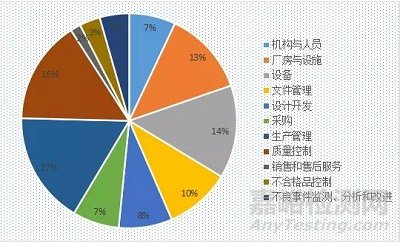
图6 2020年不合格条款占比情况
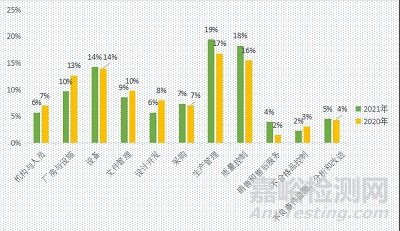
图7 2020-2021年不合格条款的对比情况
由上图可知,近两年不合格条款的分布情况基本一致;“生产管理、质量控制、设备和厂房设施”部分,是监督管控关注的重点,企业仍处于薄弱状态。企业在体系的建设和运行过程中,应重点关注以上4部分内容,内部安排不定期的自查活动,不断完善质量管理体系,以保证体系运行的充分性、适宜性和有效性。同时,监督管理部门对医疗器械上市后监管的关注度也在不断的提高,针对“销售和售后服务、不合格品控制和不良事件监测、分析和改进”部分,企业也应不断加强学习和管理。
为加强医疗器械监督管理,保障医疗器械安全有效,各级监督管理部门也在加大对医疗器械生产企业的监管力度,例如广东省、江苏省已在其官网公布相关信息,责令10多家生产企业停产整改。
在不断加强的监管环境中,企业内部应逐步完善质量管理体系,加强对产品质量的管控,以保证医疗器械产品的安全有效;同时应关注外部环境的变化,及时了解当前的监管要求,对体系进行查漏补缺,不断自查和改进,保证质量体系的有效运行,产品的合规生产。

来源:药械技术圈


