您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-08-30 11:15
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.荃信TSLP单抗获FDA批准哮喘临床。荃信生物自主研发的创新型单抗QX008N获FDA批准临床,适应症为重度哮喘。QX008N是一款重组人源化TSLP单抗,通过阻断TSLP,可阻止免疫细胞释放促炎细胞因子,从而控制病情及预防相关疾病的恶化。今年5月,QX008N已在国内获批开展用于哮喘和慢性阻塞性肺疾病适应症的临床研究,目前正在Ⅰ期临床中评估用于健康受试者的安全性、耐受性、药代动力学特征和免疫原性。
2.宜明昂科CD70抗体获FDA临床许可。宜明昂科自主研发的CD70单抗IMM40H获FDA临床试验默示许可。在临床前研究中,IMM40H对多种肿瘤具有显著抑瘤活性,较低剂量2-3次治疗即可全部清除皮下肿瘤;并且显示出良好的安全性。该新药最近也在国内获批临床,临床适应症为CD70阳性恶性肿瘤的治疗。这是宜明昂科中美同步开发的第三个新药项目。
3.复星凯特CAR-T新适应症获批临床。复星凯特CAR-T疗法「阿基仑赛注射液」获CDE批准开展新适应症临床研究,用于一线免疫化疗无效或在一线免疫化疗后12个月内复发的成人大B细胞淋巴瘤(LBCL)患者。阿基仑赛(Yescarta)是国内首款获批的CAR-T,靶向CD19跨膜蛋白,已获批用于二线或以上系统性治疗后复发或难治性LBCL患者。值得一提的是,该药用于复发或难治性惰性非霍奇金淋巴瘤(包括FL、MZL)的适应症已被CDE纳入突破性疗法。
4.德昇济KRAS抑制剂国内获批临床。德昇济医药KRAS G12C抑制剂1类化药“D3S-001胶囊”获CDE批准开展用于治疗携带KRAS p.G12C突变的晚期实体瘤的临床研究。临床前研究显示,D3S-001在分子活性、选择性、ADME(吸收、分布、代谢和排泄)以及Tox profile方面均具有显著优势,可以在纳摩尔水平上有效地将KRAS G12C蛋白全部锁在其非活性状态。D3S-001是德昇济医药中美双报的首款在研新药,正在美国开展单药用于KRAS p.G12C突变、晚期实体瘤患者的Ⅰ期临床。
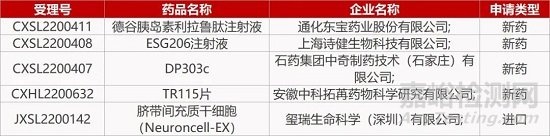
5.诗健FIC单抗国内报IND。诗健生物申报的ESG206注射液1类生物制品临床试验申请获CDE受理,拟用于治疗恶性B细胞淋巴瘤和慢性淋巴细胞性白血病患者。ESG206是一款具“First-in-Class”潜力的单抗药物,靶向一个未披露的B细胞特异靶点。ESG206经过糖基化修饰,加强了抗体介导的细胞杀伤作用。目前该新药正在澳大利亚开展首次人体试验。
国际药讯
1.阿斯利康3款药物在日获批新适应症。近日,阿斯利康宣布3款药物在日本获批新适应症,包括奥拉帕利(Lynparza)被批准作为携带BRCA突变、HER2阴性的高复发风险早期乳癌患者的辅助疗法;奥希替尼(Tagrisso)用于携带EGFR突变的非小细胞肺癌(NSCLC)患者的辅助治疗;长效补体C5抑制剂Ultomiris (ravulizumab)用于治疗成人全身性重症肌无力(gMG)。
2.创新RMS单抗Ⅲ期临床积极。TG Therapeutics公司CD20单抗ublituximab治疗复发性多发性硬化(RMS)患者的两项Ⅲ期临床(ULTIMATE I & II)达到主要终点。治疗96周后,与活性对照组相比,ublituximab治疗组患者的年复发率(ARR)显著下降,两项试验ublituximab组患者ARR分别为0.08(vs0.19,p<0.001)和0.09(vs0.18,p=0.002)。完整数据已发表在《新英格兰医学杂志》中。目前该新药的上市申请正接受FDA与EMA的审查。Ublituximab的PDUFA目标日期定于2022年12月28日。
3.诺和诺德拟启动预防肥胖的数字疗法项目。诺和诺德即将启动与Digbi Health合作的试点项目,旨在通过基因、蛋白质、肠道微生物和生活方式的数据来预测或预防肥胖及相关的心脏代谢疾病。Digbi Health能够利用肠道微生物组信号、遗传风险、健康指导、数字化健康和营养管理进行精准减肥干预,并将临床结果提高500%。该项目也是为了推动减肥产品Wegovy(司美格鲁肽)销售额的快速增长。
4.创新TCR研发公司完成A轮融资。3T Biosciences公司宣布完成4000万美元A轮融资;并自斯坦福大学获得创新T细胞受体(TCR)模拟物(mimetic)发现平台以及尚处于开发阶段的MAGE-A3 T细胞受体(TCR)-T资产的独家授权。3T Biosciences公司致力于创新TCR疗法开发,它专有的AI药物发现平台3T-TRACE已识别十多种包含结直肠癌至乳腺癌的癌症靶标蛋白,此轮资金将主要用于将一部分发现的靶标推进临床阶段。
5.mRNA技术公司完成B轮融资。疫苗及mRNA免疫疗法开发公司eTheRNA宣布完成3900万欧元的B轮融资。eTheRNA利用其专有的分子设计以及脂质生物化学方面的专业知识,能够设计和制造定制脂质纳米颗粒及基于mRNA的T细胞佐剂来克服当前mRNA治疗剂开发所面临的挑战。此轮融资将用于扩大对其综合mRNA技术平台的投资,并进一步推行合作伙伴关系驱动的业务战略,包括定制脂质纳米颗粒(cLNP)。
6.BMS抗凝药一项II期研究未达主要终点。百时美施贵宝与杨森联合开发的FXIa抑制剂milvexian,联合抗血小板药物用于预防急性缺血性中风或短暂性脑缺血发作(TIA)的II期AXIOMATIC-SSP剂量递增研究未达到主要终点。该项研究的主要终点为第90天患者新发缺血性卒中和MRI检测的新发隐性脑梗死的相关风险。结果显示,接受每日2次25mg milvexian的患者发生卒中的相关风险降低31%,50mg组降低28%,100mg组降低35%。此外,milvexian具有良好的安全性。
医药热点
1.人胚胎干细胞来源肝细胞成功治疗肝衰竭。中南大学湘雅医院“利用人胚胎干细胞诱导分化的肝细胞治疗急性/慢加急性肝衰竭的临床研究”获积极结果,首例患者已出院并且生存状况良好,细胞治疗被证明安全有效。该项目使用的肝细胞制剂,来源于人类干细胞国家工程研究中心。这也是全球首例得到人胚胎干细胞来源肝细胞治疗的肝衰竭病人。
2.校园疫情防控技术方案升级。教育部、国家疾控局联合发布《高等学校新冠肺炎疫情防控技术方案(第六版)》《中小学校新冠肺炎疫情防控技术方案(第六版)》《托幼机构新冠肺炎疫情防控技术方案(第六版)》,结合《新型冠状病毒肺炎防控方案(第九版)》要求,对疫情防控措施进一步细化明确。针对高校学生,新版方案指出,跨省区返校的低风险区高校师生员工开学前需持48小时内(以出具报告时间为准)核酸检测阴性证明,核酸检测结果全国互认,并按照属地要求,做好到达后的核酸检测。
3.四川省卫健委:不再严控“耗占比”。四川省卫健委日前发布《中共四川省卫生健康委员会党组关于省委第一巡视组巡视反馈意见整改阶段进展情况的通报》,针对全省公立医院绩效考核进行整改。其中提出,“每百元医疗收入(不含药品收入)中消耗卫生材料费”和“医学检验检查收入占比”指标均不再纳入考核范围,对应考核指标已调整为“公立医院百元医疗收入的医疗支出(不含药品收入)”和“医疗服务收入(不含药品、耗材、检查、化验收入)占公立医院医疗收入的比例”。
4.十家核酸检测公司上半年利润总和超160亿。十家核酸检测上市公司陆续公布2022年半年报,统计显示十家公司的营收总和为485.18亿元,净利润达到162.97亿元。十家公司营收和净利润均大幅增长,净利润排名前五位企业分别为:达安基因43.13亿元(132.12%)、明德生物27.6亿元(376.29%)、万泰生物26.93亿元(273.24%)、迪安诊断18.8亿元(158.54%)、金域医学16.43亿元(55.11%)。
评审动态

来源:药研发