今日头条
华东医药口服GLP-1R激动剂获批临床。华东医药旗下中美华东1类化药HDM1002片获国家药监局临床许可,拟开发用于治疗2型糖尿病成人患者。HDM1002是一款小分子GLP-1R激动剂,它通过与GLP-1受体相结合,刺激胰岛素的分泌,并且抑制胰高血糖素的分泌,从而促进葡萄糖的新陈代谢。2023年4月,该新药已在美国完成IND申请递交。
国内药讯
1.阿斯利康长效RSV单抗中国报产。阿斯利康3.1类新药nirsevimab注射液的上市申请获国家药监局受理。这是一款靶向呼吸道合胞病毒(RSV)的长效单抗药物,已在欧盟获批用以避免新生儿在首个RSV流行季到来时预防RSV感染所致的下呼吸道疾病。在临床试验中,与安慰剂相比,nirsevimab降低足月出生或早产婴儿因RSV感染需要治疗的下呼吸道感染风险79.5%(95% CI,65.9~87.7,p<0.0001)。
2.复星引进TPO-RA中国Ⅲ期临床积极。复星医药引进的新一代血小板生成素受体激动剂(TPO-RA)马来酸阿伐曲泊帕用于治疗中国成人慢性免疫性血小板减少症(ITP)患者的Ⅲ期临床达到主要研究终点。与安慰剂相比,马来酸阿伐曲泊帕治疗组6周后患者血小板反应率更高(77.08%vs7.69%),两组患者血小板反应的累计周数中位数分别为4.1周和0周。药物的总体耐受性良好,未报道严重不良反应事件。
3.康方PD-1/VEGF双抗上美国III期临床。康方生物与Summit公司联合开发的全球首创PD-1/VEGF双抗依沃西(AK112/SMT112)联合化疗用于经第三代EGFR-TKI治疗进展的EGFR突变、局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)的国际III期临床 HARMONi 研究(登记号:NCT05184712)在美国完成首例患者给药。该项目拟在美国,加拿大,欧洲和中国招募超过400例患者。目前,该项目的中国部分“AK112-301研究”已完成患者入组。
4.信达双重激动剂减重II期临床积极。信达生物GLP-1R/GCGR双激动剂玛仕度肽 (IBI362) 高剂量9mg在中国肥胖受试者的II期临床达到主要研究终点。玛仕度肽治疗24周后患者体重较基线的平均百分比变化与安慰剂组的差值达-15.4%(95%CI:-18.8%, -11.9%),P<0.0001;体重较基线的平均变化与安慰剂组差值为-14.7 kg(95%CI:-17.9 kg, -11.5 kg),P<0.0001;药物总体耐受性良好,无严重不良事件发生。
5.先声Tregs偏向性IL-2融合蛋白报IND。先声药业自研1类生物制品SIM0278注射液的临床试验申请获CDE受理。SIM0278是一款Tregs偏向性IL-2融合蛋白(IL2muFc),拟开发用于治疗多种自身免疫疾病。在多个临床前疾病模型中,SIM0278具有明显优化的PK性质,能够选择性活化Treg细胞,而不激活效应T细胞或NK细胞,从而达到恢复机体免疫平衡的作用。Almirall拥有在大中华以外地区开发和商业化SIM0278的独家授权。
国际药讯
1.肾上腺素鼻喷雾获FDA推荐批准上市。ARS Pharmaceuticals公司肾上腺素鼻喷雾剂Neffy获FDA肺过敏药物咨询委员会(PADAC)推荐批准上市,用于紧急治疗成人(≥30公斤)和儿童(18岁以下和≥30公斤)I型严重过敏反应。Neffy采用了鼻吸收增强技术Intravail®,在出现过敏反应的紧急情况下,无需打针更易于给药。祐儿医药拥有该新药在大中华区域开发和商业化授权。
2.FDA拒绝批准IL-15超级激动剂上市。ImmunityBio公司开发的IL-15超级激动剂Anktiva(N-803)与卡介苗联合治疗膀胱癌的上市申请收到FDA的完整回复函。FDA在对其第三方合同制造商进行许可前检查时发现了缺陷。FDA指出ImmunityBio必须解决的制造问题,还要求其在重新提交的文件中更新Anktiva组合的某些安全性和有效性数据。Anktiva是由IL-15突变体(IL-15N72D)与IL-15受体α/IgG1 Fc融合蛋白结合而成。
3.Gossamer公司只保留PAH研发管线。Gossamer Bio公司在第一季报中透露,该公司将裁员超25%并砍掉所有其他临床和临床前项目,全力研发拟通过干粉吸入器输送用于治疗肺动脉高压(PAH)的主要候选药物seralutinib。Seralutinib是一种靶向PDGFRα/β、CSF1R和c-KIT的酪氨酸激酶抑制剂,已在Ⅱ期临床中显示出有效改善患者肺血管阻力 (PVR)的潜力,seralutinib治疗组患者24周的PVR改善较安慰剂平均差异为-96.1 达因(p = 0.0310),相当于安慰剂校正改善14.3%。
4.β细胞再生药物公司完成2750万欧元融资。DiogenX公司宣布完成由勃林格殷格翰风险基金(BIVF)领投的A轮融资,金额高达2750万欧元(3000万美元)。DiogenX公司的主导项目是一种潜在“first-in-class”、用于疾病修饰治疗的重组蛋白疗法,旨在调节Wnt/β-catenin信号通路,以再生可制造胰岛素的β细胞,用于预防和逆转1型糖尿病(T1D)。此轮融资将用于推动其主要候选药物在T1D患者中的临床开发。
5.全球首个口服基因编辑药物临床前研究积极。SNIPR Biome公司开发的基于CRISPR基因编辑改造的噬菌体混合物口服药物SNIPR001用于清除大肠杆菌的临床前研究成果最新发表在Nature Biotechnology期刊上。该研究显示,在小鼠和猪的肠道中,SNIPR001能够有效减少大肠杆菌的出现,且耐受性良好。目前该药物已处于Ⅰ期临床阶段,旨在减少和预防血液类癌症患者肠道中大肠杆菌易位到血液而导致的致命感染。
6.SERT靶向新药CNS临床前研究积极。美国加州大学旧金山分校、耶鲁大学和杜克大学的联合研究团队基于非洲传统迷幻植物药物伊博格碱(ibogaine)的药理学原理,开发出靶向5-羟色胺转运体(SERT)的新型化合物候选药物,在临床前研究成瘾和抑郁症小鼠模型中,能在非常低的剂量下减轻小鼠这两种疾病的症状。相关研究结果已在线发表在Cell期刊上。
医药热点
1.猴痘疫情不再构成国际关注突发公卫事件。世卫组织总干事谭德塞11日宣布,猴痘病例在过去3个月的报告量比前3个月减少了近90%,经紧急委员会在10日召开会议讨论后认为,猴痘疫情不再构成“国际关注的突发公共卫生事件”。据世卫组织数据,自猴痘疫情暴发以来,总共有111个国家和地区向世卫组织报告了超过8.7万例病例,包括140例死亡病例。
2.北京基本医保报销费用全部纳入医疗救助保障范围。5月15日,北京市医保局发布《关于进一步做好因病致贫重病患者家庭医疗救助工作的通知》,基本医保报销范围内个人负担的门诊和住院医疗费用,全部纳入本市医疗救助保障范围。此外,医疗救助不设起付线,住院救助支付比例由80%提升至85%,全年救助封顶线由8万元提升至16万元;因病致贫家庭全年救助封顶线由8万元提升至15万元,按照3万元(含)以下30%、3万元以上至5万元(含)以下40%、5万元以上50%的比例分段给予医疗救助。
3.江苏出台高水平医院建设方案。近日,江苏省政府印发《江苏省高水平医院建设实施方案》,聚焦提升疑难复杂危重疾病诊疗能力、医学科技创新水平、医院整体运行效能,聚力建设一批高水平医院,力争到2025年基本建成13家左右高水平医院,其中6家左右综合实力达到国内领先水平,新增2~3个国家医学中心、5个左右国家区域医疗中心。
评审动态
1. CDE新药受理情况(05月14日)
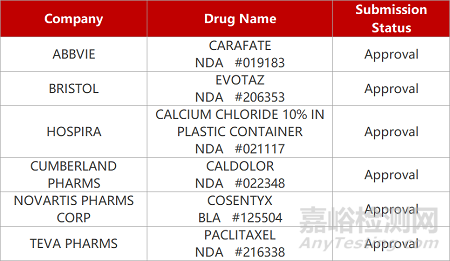
2. FDA新药获批情况(北美05月12日)