为了防止医疗器械在临床使用时引起不良反应,医疗器械生产商需要根据ISO或者GB/T提供的相关标准进行生物相容性评估。作为生物相容性测试的重要组成部分,植入后局部反应试验是生物学评价试验项目中最接近或模拟临床应用状况的一项试验,且试验中对动物选择、植入部位、植入器械的材料组成及形状大小、观察与处死动物的时间等都因医疗器械产品实际接触人体的部位以及在体内持续时间的长短而异。植入后局部反应试验通过对动物局部组织内植入医疗器械产品的代表性部分来评价其植入一定周期后对局部活组织的潜在反应,这种评价是运用组织病理技术评价植入部位的细胞反应及组织反应。根据植入部位的不同可将植入后局部反应试验划分为:肌肉植入试验、皮下植入试验、骨植入试验及脑植入试验等。
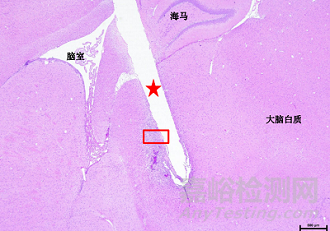
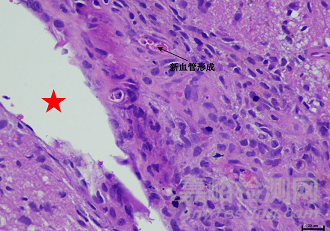
材料植入大鼠脑实质后的组织病理学照片
1、植入样品的制备
通常来讲,临床上使用的医疗器械因其尺寸太大或其它物理化学等方面原因,不宜直接植入供试动物的特定组织内。应按照临床应用中器械的暴露比例制备合适尺寸的植入小样并根据最终产品预期所用方法对每个植入样品进行加工、处理、清洗污染物和灭菌。对于用于组织工程医疗产品的支架材料,不宜预先装有细胞和/或蛋白质,因为细胞和/或蛋白质引起的动物免疫反应可能干扰局部组织反应,造成结果难以解释。对于复合材料(如骨水泥、牙科材料)在植入前可能要先混合组分,并在植入前进行固化或原位固化。非固行材料(如粉剂、凝胶)可装在两端开口的圆柱形管内,管子端口平齐光滑。
因物理特性(例如形态、密度、硬度、表面)可能影响试验材料组织反应,因此对照品的选择和/或制备也同样应该引起重视。对照材料应与试验样品具有尽可能相近的物理或化学特性,如多孔器械、可降解材料等常会引起一定的组织、细胞反应,选择同类型的对照材料可降低最终评分,同时也是比较合适的。常用的且经济易获得的阴性对照材料有聚乙烯(PE)、聚丙烯(PP)、聚四氟乙烯(PTFE)、或高密度聚乙烯(HDPE)等。
下表给出了各种植入类型所推荐的植入样品的描述:
|
植入类型 |
植入样品规格 |
|
皮下植入 |
圆盘状材料应制成直径10 mm ~ 12 mm、厚度0.3 mm~1.0 mm棒状或圆柱状材料应制成直径1.5 mm~2 mm、长5 mm~10 mm、两端圆钝 |
|
肌肉植入 |
一般采用宽1 mm~3 mm、长度约10 mm直径最大为10 mm、厚度3 mm |
|
骨植入 |
兔:直径2 mm、长6 mm的圆柱状犬和羊:直径4 mm、长12 mm的圆柱状 |
|
脑植入 |
棒状或楔形植入物:直径/截面不超过1mm×1mm, 长度2 mm~6 mm直径8 mm的圆盘 |
2、植入周期的选择
根据临床接触时间或材料预期引起生物学反应的时间来确定试验周期。
非吸收性材料,根据临床接触时间,短期可选择评估植入后1周和4周的局部反应,长期可选择评估植入后13周和/或26周的局部反应。
可吸收性/可降解材料一般考虑涵盖三个时间点,分别是:无降解或降解初期、降解中间期(降解速率最快,降解程度一半)、当植入材料完全吸收或处于稳定状态。必要时可以再增加一个长期时间点。
下表给出了非吸收性材料长期研究中普遍可接受的观察周期:
3、植入部位的选择及注意事项
肌肉植入
临床上植入肌肉组织或近似组织,或其它非皮下组织、骨或脑组织的医疗器械,一般外部接入的间接或直接接触血液的器械也可考虑选择肌肉植入。手术创伤带来的影响在肌肉植入评价中显得尤为突出。植入材料的局部生物学反应与材料特性和手术创伤反应有关,术后植入物周围组织结构的改变随时间而变化。植入后的最初2周,可能很难将外科手术所致的反应与植入物引起的组织反应区分开来。在肌肉中,植入9周至12周时细胞群呈稳定状态,这取决于动物种属和手术创伤的严重程度。
皮下植入
临床上植入皮下组织或近似组织。用钝性分离器在皮下位置分离出放置植入物的囊袋,避免各植入物游离重叠,如果植入物为片状,避免片状物折叠。
骨植入
骨固定器械、骨修复材料等。根据动物种属和植入大小,选择植入胫骨或者股骨。
脑植入
脑部植入电极、脑积水分流器、引流器等。供试品和对照品应使用等同的解剖学位点,每只动物应只植入一侧大脑半球且只能植入供试品或者对照品。大鼠可植入1个位点,兔最多可植入2个位点。
参考文献:
[1] GB/T 16175-2008医用有机硅材料生物学评价试验方法
[2] YY/T 0127.8-2001口腔材料生物学评价 第 2 单元:口腔材料生物试验方 法 皮下植入试验
[3] ISO 7405: 2018 Dentistry-Evaluation of biocompatibility of medical devices used in dentistry
[4] GB/T 14233.2-2005 11 医用输液、输血、注射器具检验方法 第 2 部分:生物学试验方法
[5] USP88Biological Reactivity Tests, In Vivo
[6] ISO 10993-6:2016 Biological evaluation of medical devices — Part 6: Tests for local effects after implantation
[7] GB/T 16886.6-2015医疗器械生物学评价 第6部分:植入后局部反应试验
[8] ISO 10993-12:2021 Biological Evaluation of Medical Devices - Part 12: Sample Preparation and Reference Materials
[9] GB/T 16886.12-2017医疗器械生物学评价 第 12 部分:样品制备与参照材料