紫杉醇(Paclitaxel, PTX)是一种重要的紫杉烷类化疗药物。紫杉醇的抗肿瘤活性来自其与微管的高亲和力,稳定和改善微管蛋白的聚合,有效抑制细胞有丝分裂、细胞内转运,最终导致肿瘤细胞凋亡。紫杉醇由于水溶性差和渗透性差,口服生物利用度低,其天然形式临床应用受到限制。此外,由于其结构中缺乏可修饰的功能基团,因此在试图提高其溶解度时,对天然紫杉醇进行化学改变非常复杂。因此,选择合适的给药系统对提高紫杉醇的临床应用、安全性和有效性至关重要。
Taxol®是紫杉醇的第一个通用产品,采用了50:50乙醇和Cremophor ELTM(聚氧乙基化蓖麻油)混合物的共溶剂策略。虽然该方法克服了溶解度问题,但Cremophor ELTM存在非线性药代动力学和严重的剂量限制性毒性,如超敏反应、神经毒性和肾毒性。由于这些不良反应,Taxol ®以135或175 mg/m2的剂量,每3周~4周给药1次,每次需要输注3小时以上。为了预防发生过敏反应,在紫杉醇治疗前12小时口服地塞米松10mg,治疗前,6小时再囗服地塞米松10mg,治疗前30~60分钟给予苯海拉明肌注20mg,静注西咪替丁300mg或雷尼替丁50mg。此外,Cremophor ELTM需要使用特殊的IVEX-2过滤器,以避免滤器中增塑剂浸出到产品中。Taxol®规格为5ml:30mg的冻干粉,使用前需要用葡萄糖或生理盐水稀释,单次使用量为7-9瓶。
考虑到Cremophor ELTM毒性较大,开发不含Cremophor ELTM,且溶解性好的紫杉醇制剂成为临床急需。2003年在中国获得批准紫杉醇脂质体(力朴素),它是一种由PTX、卵磷脂﹑胆固醇﹑苏氨酸﹑葡萄糖组成的脂质体。与Taxol®相比,力朴素对乳腺癌、非小细胞肺癌和胃癌具有相似的活性,但副作用要小得多。力朴素规格与给药剂量与Taxol®一致。与Taxol®相似,为预防紫杉醇可能发生的过敏反应,在使用前30分钟需要预处理:静脉注射地塞米松5-10mg;肌肉注射苯海拉明50mg;静脉注射西米替丁300mg。
Abraxane TM是PTX的另一种上市药物,由Abraxis BioScienc生产,并于2005年获得FDA批准。本品中PTX的配制采用人血清白蛋白(HSA)。HSA是血液中含量最多的血浆蛋白,其半衰期长达19小时,可与疏水物质不可逆结合,在体内运输,并将其运送到细胞表面。此外,HSA在细胞摄取和胞吞作用中起着重要作用,因为它与gp60和其他在恶性细胞中高表达的蛋白质(如酸性和富含半胱氨酸的分泌蛋白(SPARC))结合。根据Abraxis BioSciences公司获得的结果,Abraxane TM具有线性药代动力学特征,与Taxol®相比,其瘤内浓度高出33%。给药剂量提高至260mg/m2,滴注时间缩短为30分钟且无需进行过敏预处理。Abraxane TM规格为100mg,单次使用量约为4瓶。目前,石药欧意药业、江苏恒瑞医药、湖南科伦制药、海正药业等6家国内药企均已过评注射用紫杉醇(白蛋白结合型)。
另一种上市药物Genexol-PMTM由Samyang Corporation公司开发,于2007年在韩国获得批准。它由PTX和聚乙二醇-聚乳酸嵌段聚合组成的胶束。粒径为20~50nm。临床研究表明,Genexol-PMTM具有剂量依赖的药代动力学和良好的耐受性,特别是对晚期胰腺癌或转移性乳腺癌患者。2018年, 欧盟批准Oasmia公司 Apealea®上市,联合卡铂用于首次复发的铂敏感性上皮性卵巢癌、原发性腹膜癌、输卵管癌成人患者的治疗。此次批准适用于28个欧盟成员国及欧洲经济区成员国冰岛、列支敦士登和挪威。该产品也是一种紫杉醇胶束,使用公司专有的赋形剂XR17。XR17是一种基于维生素A的物质,可形成 20-60nm大小的胶束。2021 年,上海宜众紫杉醇胶束获得NMPA批准上市,该产品以自主研发的全新药用辅料单甲氧基聚乙二醇 2000-聚丙交酯两亲嵌段共聚物为载体,的由于mPEG长循环作用,聚合物胶束包载的紫杉醇缓慢释放,24小时内释放65%,48小时释放95%。使用该产品前无需以抗组胺药进行预处理,最高耐受剂量为390 mg/m2,高于紫杉醇注射液(Taxol)的200 mg/m2和紫杉醇白蛋白纳米粒(Abraxane)的300 mg/m2。
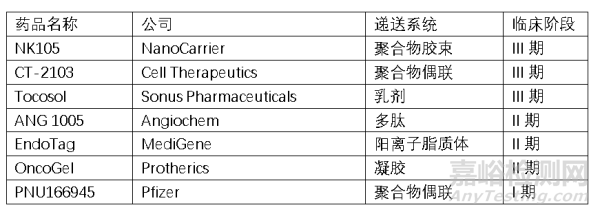
以上几个产品均是针对紫杉醇注射液毒性及溶解性进行改良,然而Genexol PM®在物理上不稳定,对多药耐药肿瘤治疗无效。Abraxane®表现出有限的肿瘤摄取、肿瘤消除和更高的半数抑瘤浓度。更多的递送系统进一步开发,根据文献报道与Genexol PM®相比,聚乙二醇-共乳酸和d -a-生育酚聚乙二醇- 1000琥珀酸盐组成的紫杉醇混合胶束对多药耐药肿瘤细胞有效;与Abraxane®相比,重组嵌合多肽结合的紫杉醇纳米颗粒具有2倍的全身肿瘤暴露,肿瘤摄取和几乎完全的肿瘤消退;紫杉醇载聚己内酯-co- d -a-生育酚聚乙二醇1000琥珀酸纳米颗粒的最大抑制浓度是Abraxane®的8倍;以下是一些进入临床的新型紫杉醇制剂。
2.口服剂型
为了提高临床使用顺应性,同时降静脉注射可能引发的注射液外渗、静脉炎等不良反应口服紫杉醇制剂也一直是研发热点。紫杉醇在口服时,会被胃肠道细胞的P-糖蛋白泵排出。为此,Athenex公司通过与新型P-糖蛋白抑制剂Encequidar进行联合口服,对肠道中P-糖蛋白的活性进行局部抑制,从而在提高药物吸收,减少副作用。与传统静脉注射紫杉醇相比,口服紫杉醇组的疗效显著提高,总缓解率为36%,而静脉注射紫杉醇组为24%;同时,神经病变发生率和严重程度较低,脱发,关节痛和肌痛的发生率也降低。然而,FDA拒绝了该疗法上市申请,理由是与静脉注射紫杉醇相比,口服紫杉醇可能有4级中性粒细胞减少,3级呕吐和未确定的胃肠道并发症,而这些副作用可能危及患者生命或者需要住院治疗。并且该疗法给药机制所依赖的Encequidar成分并没有得到FDA的审批。FDA认为,如果想要获得批准,就需要采取额外的风险缓解策略来改善产品的毒性问题,包括剂量优化和/或排除被认为具有高毒性风险的患者。另一种口服制剂RMX3001(韩国原产品代码为DHP107,注册名为Liporaxel)是由DAEHWA Pharmaceuticals韩国大化公司与韩国科学技术研究所共同开发,已于2016年9月9日成功获得韩国食品与药品监督局的上市批准,适应症为晚期和转移性或局部复发性胃癌,是全球第一个开发成功并获批上市的口服紫杉醇产品。其优势在于Liporaxel是在脂质自乳化DH-LASED技术的基础上开发的,脂质形成胶束,黏附于小肠绒毛,脂乳吸收过程中形成药物乳糜颗粒而被吸收。该产品无需给药预防超敏反应,无注射型紫杉醇带来不良反应;可在不使用P-糖蛋白抑制剂或吸收促进剂的情况下施用。一项多中心、随机、开放的III期临床研究比较紫杉醇口服溶液(RMX3001/DHP107)与紫杉醇注射液(泰素®) 二线治疗晚期胃癌患者疗效和安全。结果显示口服溶液疗效不逊于紫杉醇注射液(泰素®),神经毒性、白细胞减少、脱发等不良反应较注射液更轻。
3、改剂型新药设计考虑
紫杉醇制剂从普通的注射剂到采用各种递药系统改善毒性和溶解性注射剂再到增加顺应性降低毒性的口服制剂。从不同紫杉醇制剂的开发历程可以看出改剂型新药设计上首先要立足于明确的临床需求,比如提高有效性、改善安全性、提高依从性。其次,要有一定的技术储备,在对原料的药学性质充分了解的基础上结合自身的技术平台(新辅料、新技术等)进行新剂型的开发;采用新辅料时,一定要对新辅料的安全性进行充分评估;改变给药途径后密切关注其药动学变化及由此带来的其他副作用。此外,临床实验的设计也至关重要,选择合适的适应症,合适的试验人群,合理的给药剂量是项目成功的助推器。综上所述:临床需求,先进的技术平台,创意的想法以及合理的临床实验设计是成功开发改良型新的关键要素。
参考文献
1. Haddad, R.; Alrabadi, N.; Altaani, B.; Li, T. Paclitaxel Drug Delivery Systems: Focus on Nanocrystals’ Surface Modifications. Polymers 2022, 14, 658.
2. A, P., Kar, S., Vignesh, K., Kolhe, U.D. (2020). An Overview of Paclitaxel Delivery Systems. In: Saneja, A., Panda, A., Lichtfouse, E. (eds) Sustainable Agriculture Reviews 43. Sustainable Agriculture Reviews, vol 43. Springer, Cham.
3. Ma P, Mumper RJ. Paclitaxel Nano-Delivery Systems: A Comprehensive Review. J Nanomed Nanotechnol. 2013 Feb 18;4(2):1000164.