随着辅助生殖技术用医疗器械市场的快速发展,对相关设备的风险管理变得尤为重要。国家药品监督管理局也陆续发布了关于体外辅助生殖技术用液、胚胎移植导管、穿刺取卵针的注册技术审查指导原则。鼠胚试验作为评价胚胎发育潜在毒性的重要手段,试验结果不仅可以支持申报产品安全性;对于产品持续安全性的保持,鼠胚试验也能作为产品批放行的重要依据。
哪些医疗器械需要进行鼠胚试验?
对于可能接触卵子、合子或胚胎的产品,需考虑进行鼠胚试验。
比较国家行业标准和FDA指南,关注点有什么差异?
a、试验样品的选择
行业标准YY/T 1434并没有对试验样品有额外的考虑。但是FDA指南建议选择至少3个独立产品进行试验以减少不同产品之间的变异性。并且样品应为同一批中不同货架寿命的产品,如零时刻和货架有效期终点产品均应参与测试,以减少产品老化及与容器相互作用对试验结果的影响。
b、对照样品
FDA指南建议鼠环试验应选择同类已上市产品作为对照组,而目前行业标准中没有采用已上市产品作为对照的考虑。
c、浸提时间
FDA指南建议对于临床使用小于30分钟的产品,应至少浸提30分钟以评估最坏的暴露情况。对于临床使用超过30分钟的产品,浸提时间应至少为临床使用时间的两倍。而行业标准要求按照GB/T 16886.12合理选择浸提条件。
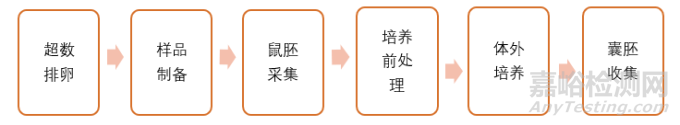
辅助生殖技术用医疗器械的体外鼠胚试验检测方法
体外鼠胚试验一般分为以上几个步骤,试验通过供试品与胚胎接触,体外培养一定时间后观察囊豚质量,并计数发育良好的囊豚数。
需要注意的是体外鼠胚试验有1-细胞万法和2-细胞方法,由于1-细胞方法对培养环境更加灵敏,所以行业标准推荐使用1-细胞胚胎方法。此外标准中建议了供试品的接触时间和接触方式,需要根据体外培养的实际操作情况,让鼠环在待测液体中孵育时间尽可能的接近实际培养时间。
结果判定
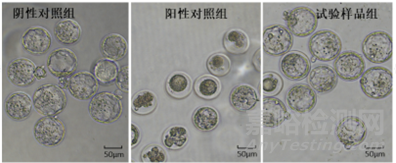
使用形态观察法观察囊胚形态。发育良好的囊豚,囊豚腔充分扩张,内细胞团大小适中,滋养层细胞连接紧密且大小均匀。发育差的囊胚。囊胚腔小,内细胞团小或无细胞团,滋养层细胞稀疏。
记录囊胚数后,计算囊胚形成率。阳性对照组的囊胚形成率应显著低于阴性对照组阴性对照组囊胚形成率280%。如果检测组的囊胚形成率280%,表示检测样品对胚胎发育没有潜在毒性。