今日头条
君实PD-1单抗获FDA批准上市。君实生物与Coherus BioSciences合作开发的PD-1单抗Loqtorzi(toripalimab,特瑞普利单抗)获FDA批准上市,联合吉西他滨/顺铂一线治疗晚期复发或转移性鼻咽癌(NPC)患者,以及单药用于治疗复发或转移性NPC经治患者。Loqtorzi也是FDA批准用以治疗NPC的首个PD-1单抗。在Ⅲ期临床JUPITER-02中,与化疗相比,toripalimab联合化疗使患者疾病进展或死亡风险降低48%。在POLARIS-02研究中,toripalimab用于单药治疗达到20.5%的客观缓解率。
国内药讯
1.礼新Claudin 18.2-ADC拟纳入突破性治疗品种。礼新医药Claudin 18.2-ADC创新疗法LM-302获CDE拟纳入突破性治疗品种,用于既往接受过二线及以上系统治疗的Claudin18.2阳性的局部晚期或转移性胃或胃食管交界处腺癌。LM-302通过特异性靶向Claudin18.2阳性肿瘤细胞结合并内吞,在肿瘤细胞溶酶体内释放毒素载荷,从而杀伤肿瘤细胞。在美国,该新药已获得FDA授予针对胰腺癌,胃癌及胃⻝管交界部癌和胆管癌的三项孤儿药资格。
2.罗氏ALK抑制剂拟纳入突破性治疗品种。罗氏新一代ALK抑制剂盐酸阿来替尼胶囊获CDE拟纳入突破性治疗品种,用于间变性淋巴瘤激酶(ALK)阳性非小细胞肺癌(NSCLC)患者的术后辅助治疗。公布于ESMO2023大会上的国际Ⅲ期ALINA研究结果显示,与含铂化疗相比,阿来替尼辅助治疗可以使完全切除的IB(肿瘤≥4 cm)至IIIA期ALK阳性NSCLC患者的疾病复发或死亡风险降低76%。
3.天广实/康源博创创新三抗报IND。天广实与康源博创联合申报的1类生物制品MBS314注射液的临床试验申请获CDE受理。这是第2款申报临床的CD3/GPRC5D/BCMA三特异性抗体,已在临床前研究中显示出比CD3/BCMA双抗(alnuctamab,BMS)以及CD3/GPRC5D双抗(Talquetamab,强生)有更好的肿瘤杀伤效果。今年10月初,信达生物同类产品IBI3003已在Clinicaltrials.gov网站登记注册一项Ⅰ/Ⅱ期临床,拟评估用于治疗多发性骨髓瘤的安全性与初步疗效。
4.瑞顺CD19-CAR-DNT疗法报IND。广东瑞顺生物1类生物制品RJMty19注射液的临床试验申请获CDE受理,拟开展用于治疗复发/难治性B细胞非霍奇金淋巴瘤(r/r NHL)的新药研究。RJMty19是一款由瑞顺生物基于人源化CD19-CAR结构域全球专利开发的一款具有全球创新性的通用型双阴性T细胞 (DNT)细胞产品。在研究者发起的的临床研究中,RJMty19能剂量依赖性提高r/r B-NHL受试者临床疗效,且具有良好的安全性。
5.复宏汉霖PD-1单抗海外授权。复宏汉霖宣布与Intas Pharmaceuticals达成合作许可协议,授予后者在欧洲和印度独家开发和商业化PD-1单抗汉斯状(斯鲁利单抗)包括广泛期小细胞肺癌(ES-SCLC)等多项适应症权益。根据协议,复宏汉霖将获得4200万欧元的首付款、4300万欧元的监管里程碑付款、1亿欧元的商业化里程碑付款以及产品的特许权使用费;复宏汉霖将负责斯鲁利单抗在欧洲和印度的临床开发及上市后的产品生产和供应。
国际药讯
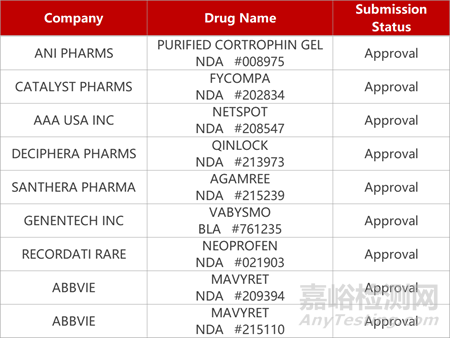
1.杜氏肌营养不良新药获FDA批准上市。Santhera公司创新类固醇药物vamorolone获FDA批准上市,用于治疗2岁及以上杜氏肌营养不良(DMD)患者。在IIb期临床(VISION-DMD)中,vamorolone的疗效与强的松相比达到非劣效标准;而且并未发现vamorolone在骨骼健康生物标志与线性生长上有负面的影响。曙方医药拥有vamorolone在大中华区开发和商业化的独家权益。
2.罗氏VEGF-A/ANG-2双抗获批治疗RVO。罗氏旗下基因泰克VEGF-A/ANG-2双抗Vabysmo(faricimab)第三项适应症获FDA批准,用于治疗视网膜静脉阻塞(RVO)。在两项III期研究(BALATON和COMINO)中,与aflibercept相比,Vabysmo在改善患者因RVO引起的黄斑水肿与视力损害方面达到非劣效性,患者视力平均改善的视力表字母分别为16.9个vs17.5个,以及16.9个vs17.3。此前,faricimab已获批用于治疗糖尿病黄斑水肿和湿性年龄相关性黄斑变性。
3.礼来IL-23单抗获FDA批准治疗UC。礼来IL-23p19单抗Mirikizumab(商品名:Omvoh)获FDA批准上市,用于治疗成人中重度溃疡性结肠炎(UC)。Mirikizumab旨在通过与IL-23的p19亚基结合以阻断IL-23介导的炎症反应。在III期LUCENT-2研究中,在接受12周mirikizumab治疗后获得应答的患者中,约一半(49.9%)接受mirikizumab维持治疗的患者在1年后获得临床缓解,而安慰剂组这一数值为25.1%。目前该新药用于克罗恩病适应症研究已进入III期临床。
4.ImmunityBio公司IL-15融合蛋白重报BLA。FDA受理ImmunityBio公司重新提交的IL-15超级激动剂Anktiva(N-803)的上市申请,联合卡介苗(BCG)用于治疗非肌层浸润性膀胱癌原位癌(CIS)。PDUFA日期为明年4月23日。II/III期研究(QUILT 3.032)更新数据显示,应答受试者的缓解持续时间延长,患者完全缓解(CR)维持时间≥24个月的概率为60%,≥24个月时无膀胱切除率超过90%;安全性与之前的报告相同。
5.创新Aβ疫苗达Ⅱ期临床主要终点。Grifols集团旗下Araclon Biotech公司靶向β淀粉样蛋白(Aβ)40肽的活性疫苗ABvac40,在治疗早期阿尔茨海默病(AD)的Ⅱ期试验达到主要终点。ABvac40旨在激发人体免疫系统对Aβ的免疫反应,以达到清除Aβ来延缓AD的进展。结果显示,ABvac40治疗与安慰剂组相比引发的不良反应发生率相似;ABvac40治疗将疾病进展的速度减慢38%。
6.Prime Editor基因疗法GSD1b临床前研究积极。Prime Medicine公司开发的靶向肝脏的先导编辑器(Prime Editors)基因疗法,在用于治疗Ⅰb型糖原贮积病(GSD1b)的临床前研究中获得概念验证结果。单次静脉输注第14天,非人灵长类动物(NHP)中p.L348的全肝精确编辑高达50%,没有显著在靶标上的非预期编辑;高达83%的关键靶细胞(肝细胞)精确编辑了两个等位基因。在小鼠模型中,p.L348fs突变全肝精确校正率高达56%。研究中未观察到安全性问题。
医药热点
1.国家规范化疼痛诊疗中心成立。10月20日,国家规范化疼痛诊疗中心在北京大学人民医院揭牌成立。未来,国家规范化疼痛诊疗中心将计划在全国建设20-30家县(市、区〕级医疗机构“国家规范化疼痛诊疗中心”,以超声引导下神经阻滞镇痛技术为重点,推动疼痛门诊规范化治疗,为基层疼痛诊疗中心标准化建设发挥示范作用。
2.2023中国胡润百富榜公布。10月24日,胡润研究院发布《2023中国胡润百富榜》,今年首富依然是养生堂的钟睒睒,凭借着4500亿元的财富,再次成为中国首富。此外,迈瑞医疗李西廷(1000亿元)、徐航(1000亿元),爱尔眼科陈邦(800亿元),智飞生物蒋仁生(680亿元),健康元朱保国(640亿元),恒瑞孙飘扬(610亿元),扬子江徐浩宇(600亿元),恒瑞、翰森的岑均达(500亿元),药明康德李革(450亿元)等纷纷上榜。
3.上海“瑞金医院持刀砍人”案宣判。10月27日,上海市第二中级人民法院依法公开宣判被告人侯晓飞故意杀人案,以故意杀人罪判处侯晓飞死刑,剥夺政治权利终身。上海二中院经审理查明,被告人侯晓飞因投资失败、无力偿还巨额债务等原因而对社会心生怨恨,决意以在公共场所持刀捅人的方式报复社会。2022年7月9日上午,侯晓飞在上海瑞金医院门诊大楼持刀连续捅刺、追砍多名在该院就诊的病患、陪同家属及医护人员,造成包括4名未成年人在内的6名被害人重伤,9名被害人轻伤、轻微伤,后被赶至现场的公安人员制服。
评审动态
1. CDE新药受理情况(10月28日)
2. FDA新药获批情况(北美10月26日)