琼脂糖作为一种具有优异生物相容性的天然来源多糖,在生物医药领域中可以作为一种良好的载药/控释材料。目前,采用生物/物理/化学修饰方法,改变琼脂糖的分子结构可以获得良好的性能扩展。琼脂糖基的生物材料可以应用于药物递送、组织工程、分离和包被敷料等一系列领域。
图1:琼脂糖基生物材料在生物医药领域中的应用前景
琼脂糖是从红藻中提取的一种线性天然多糖,分子量在80-140kDa之间。在温度90℃以上时,琼脂糖结构单元之间的氢键断裂,琼脂糖分散到水中形成透明溶液;当温度降至30-40°C时,琼脂糖的分子链通过氢键交织在一起,形成紧密排列形成凝胶的双螺旋结构。
图2:琼脂糖的结构和其形成胶凝的机制示意图
天然基质的药物递送载体,如壳聚糖、纤维素和淀粉等广泛受到人们的关注。壳聚糖存在需要在酸性介质中溶解、孔径均一性较难控制等问题,纤维素存在水溶性和热塑性差问题,淀粉水溶很高而难用于药物缓释中,且存在机械性能差的问题。琼脂具有相当的粘弹和热塑性,非常适合用于控制药物的释放。
化药
以癌症应用为例,肿瘤它不仅仅是一个肿块,是由肿瘤细胞所组成,肿瘤细胞被包括免疫细胞、肿瘤干细胞在内的一系列基质所包围。化疗、放疗和手术这些常见的治疗方法往往具有包括剂量高、副作用大和特异性差在内的诸多缺点。基于聚合物靶向递送药物体系(水凝胶、纳米颗粒等)可以最大化解决上述问题。
图3:腐植酸钠(sodium humate)和阿霉素(doxorubicin)的组合可注射热响应琼脂糖水凝胶技术,诱导化疗和光热治疗
水凝胶一般是高度亲水的,而许多化疗药物往往具有疏水性,那么怎么来解决这个问题呢?表面活性剂(吐温80、泊洛沙姆和十二烷基硫酸钠)这些两亲性物质的加入可以使得药物在水凝胶中得到良好分布。
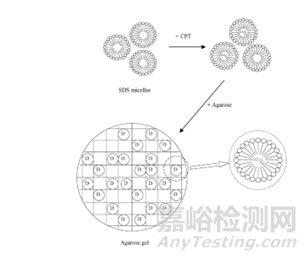
图4:十二烷基硫酸钠(SDS)提高了琼脂中喜树碱(CPT)的负载能力示意图
核酸药物
核酸治疗药物包括基于DNA修饰的DNA药物(例如基于病毒载体的体内基因治疗药物、体外基因治疗药物、裸质粒药物等)与RNA药物(例如反义寡核苷酸药物(ASO)、siRNA药物和mRNA基因治疗等),这些药物的体内降解,靶向差,细胞的摄取吸收是值得注意问题。
目前比较成熟的递送系统为GalNAC(N-乙酰半乳糖胺)递送系统和LNP。GalNAc是去唾液酸糖蛋白受体(ASGPR)的高亲和力靶向配体,ASGPR是一种内吞性受体,在肝细胞的膜表面上高度特异性地表达。ASGPR和网格蛋白介导的内吞作用可以有效地将GalNAc从细胞表面转运至细胞质。2018年LNP首次作为siRNA载体出现在人们视野中,因新冠疫情作为疫苗载体而被人们熟知。目前,FDA批准上市的核酸药物及其递送系统中未见任何凝胶辅料。
表1:FDA批准上市的核酸药物及其递送系统
那么,凝胶或者说琼脂糖基生物材料真的不适用于核酸药物吗?已有研究表明,琼脂糖纳米载体可用于递送核酸(DNA)。
图5:pH敏感的氨基酸修饰的琼脂糖纳米载体用于递送核酸(DNA)。其中,AEAm和AECAm为修饰后的琼脂糖,药物在酸性条件结合,碱性条件释放
蛋白类药物
蛋白质类药物在过去的几十年里有了显著的发展,并在医学的许多领域发挥了重要作用。1986年鼠源单抗 Orthoclone OKT3 (防止肾脏移植后的宿主排斥)是第一个被美国FDA批准的蛋白类药物,至今已有200款左右的蛋白类(单抗、多抗和ADC)药物上市。目前,上述蛋白类药物为注射给药为主。
图6:FDA批准上市的蛋白类药物(数据截止2023年上半年)
蛋白质疗法通常需要在很长一段时间内重复给药。蛋白质的不稳定性是开发其控制和持续释放系统的主要障碍。许多系统(脂质体、胶束等)以期望将蛋白药物进行体内递送,但是往往也避免不了网状内皮系统的捕获。聚合制剂常见于原位凝胶制剂辅料,聚合物如PLGA的降解会释放酸性副产物(乳酸和乙醇酸)而诱导炎症,降低产品功效。针对蛋白药物,PLGA羧酸端基的存在可以与被封装蛋白的正电荷相互作用,改变甚至阻止其释放;而且治疗性蛋白暴露在酸性pH下会诱导其聚集或影响其活性。(不可否认的是,PLGA许多凝胶制剂的领头羊,在药物递送系统体系下具有广阔的市场前景)
表2:FDA批准上市的原位凝胶药物
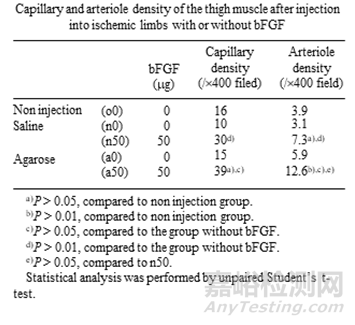
实际上,很早以前就已经有人开发和表征蛋白质类注射药物在琼脂糖水凝胶中的载药系统。成纤维细胞生长因子(bFGF)是通常用于组织再生或血管生成的生长因子之一,Moribe K 等人通过乳化/凝胶化的方法制备了琼脂糖凝胶颗粒作为bFGF的缓释载体或储库,且bFGF的琼脂糖水凝胶颗粒增强了血管生成功效。
表3:bFGF的琼脂糖水凝胶颗粒增强了血管生成功效
琼脂糖基材料在药物递送中具有初始爆发释放而不是持续控释阶段问题,琼脂糖基材料的功能化来改造药物递送体系,可以解决其在缓释/受控体系应用中受限的问题。
图7:多层功能化琼脂糖基水凝胶控制蛋白释放
细胞类药物
琼脂糖很少用于细胞移植,但是它们可以保护细胞免受恶劣生理条件的影响的潜在益处。含有琼脂基生物材料的3D培养提供了模拟各种生理相关的情况,并且可以在临床前试验中最小化动物模型的使用。
图8:基于琼脂糖的球状体培养在体外增强了人牙泡细胞(HDFC)的干性。注:Sox2、Oct4 和Nanog 是维持干细胞多能性和干性的重要转录因子
图9: Pubmed以“((drug) OR (delivery)) AND (agarose)”为关键搜索到的文章篇数
以研究数来看,琼脂糖基凝胶递送研究热度在减(图9),但琼脂糖基生物材料因其独特的理化性质而显示出巨大的应用潜力,特别是在药物递送的研究中。但是不可否认的是琼脂糖基生物材料存在降解速率慢、溶解温度高、某些药物的吸附/解吸速度慢等问题。当然,同其他天然基质类似,经过修饰后的琼脂会具有更出色的药物递送应用,琼脂糖基生物材料以及改良的琼脂糖基生物材料的实际应用仍还有很长一段路要走。
Reference
1. https://doi.org/10.1016/j.ejps.2005.02.013.
2. https://doi.org/ 10.1021/acsbiomaterials.8b01147.
3. https://doi.org/10.1002/macp.201900201.
4. https://doi.org/10.3109/10837459709022618.
5. https://doi.org/10.1080/10837450802309661.
6. https://doi.org/10.1016/j.carbpol.2013.12.069
7. https://doi.org/10.1007/s11626-021-00591-5
8. https://doi.org/10.3390/md21050299