今日头条
康柏西普眼用注射液获批DME临床。康弘药业康柏西普眼用注射液获国家药监局批准开展Ⅰ期临床,拟评估高剂量康柏西普眼用注射液治疗糖尿病黄斑水肿(DME)的安全性和有效性。康柏西普是一款VEGF靶向生物创新药,此前已获批用于治疗新生血管性(湿性)年龄相关性黄斑变性(wAMD);继发于病理性近视的脉络膜新生血管引起和DME引起的视力损伤;以及视网膜静脉阻塞(RVO)的黄斑水肿引起的视力损伤。
国内药讯
1.泰诺麦博破伤风抗体报产。泰诺麦博利用其HitMab技术平台自主开发的重组抗破伤风毒素(TT)天然全人源单抗TNM002注射液的上市申请获CDE受理,用于被动免疫预防成人破伤风感染。此前,该产品已被CDE纳入突破性治疗品种和优先审评名单。TNM002注射液通过肌肉注射给药,无需额外皮试。去年8月,FDA已授予TNM002快速通道资格。
2.恒瑞PD-1抑制剂报宫颈癌NDA。恒瑞医药PD-1抑制剂卡瑞利珠单抗的新适应症上市申请获CDE受理,联合多靶点酪氨酸激酶抑制剂法米替尼用于二线治疗宫颈癌患者。公布于ESMO2023年会上的II期临床显示,BICR评估的卡瑞利珠单抗联合法米替尼组ORR为41.0%,中位PFS为8.1个月。此前,卡瑞利珠单抗上述适应症已被CDE纳入突破性治疗品种。
3.礼来可逆BTK抑制剂中国报产。礼来非共价BTK抑制剂匹妥布替尼(pirtobrutinib)的上市申请获CDE受理,用于既往接受过BTK抑制剂治疗的复发或难治性套细胞淋巴瘤(MCL)。在Ⅰ/Ⅱ期BRUIN临床中,pirtobrutinib在这类难治性患者中达到50%(95% CI:41-59)的缓解率,分别有13%与38%的患者达成完全与部分缓解。今年1月,Pirtobrutinib已获FDA批准上市,成为首个针对BTK抗性癌症的BTK抑制剂,商品名为Jaypirca。
4.乐普EGFR-ADC获鼻咽癌快速通道资格。乐普生物开发的表皮生长因子受体(EGFR)靶向抗体药物偶联物(ADC)MRG003获FDA授予快速通道资格(FTD),用于治疗复发性或转移性鼻咽癌(R/M NPC)。公布于ESMO2023会议上的IIa期临床结果显示,MRG003(2.0mg/kg和2.3mg/kg)的ORR分别为39.3%和55.2%,DCR分别为71.4%和86.2%。此前,该产品已被FDA授予孤儿药资格,以及CDE授予突破性治疗品种。
5.特科罗JAK1/Tyk2抑制剂早期临床积极。特科罗生物JAK1/Tyk2小分子抑制剂TDM-180935外用软膏用于治疗特应性皮炎/湿疹的美国Ⅰ期临床(NCT05525468)结果积极。数据显示,在不同剂量TDM-180935组中,每天涂药1次,连续使用4周,没有出现或仅有个别受试者出现极低的系统性药物暴露;TDM-180935四个浓度(0.25%至2.0%)都显示出很好的耐受性,没有发现任何与药物相关的安全性问题。
6.南京尧唐体内基因编辑药物报IND。尧唐(南京)生物自主研发的1类生物制品YOLT-201注射液的临床试验申请获CDE受理。YOLT-201是尧唐生物基于其专有高通量基因编辑器进化平台开发的体内基因编辑药物,采用mRNA-LNP递送系统,瞬时表达基因编辑工具,从而减少脱靶风险。YOLT-201拟开发用于治疗转甲状腺素蛋白淀粉样变(ATTR),是尧唐生物的首发管线。
国际药讯
1.诺华口服PNH新药获FDA批准上市。诺华补体B因子抑制剂Fabhalta(iptacopan)获FDA批准上市,成为首个口服单药疗法,用于治疗成人阵发性夜间血红蛋白尿症(PNH)。在Ⅲ期临床APPLY-PNH中,在24周不需要输血的情况下,iptacopan治疗实现血红蛋白水平较基线增加2g/dL的患者比例达到82.3%;有95.2%患者接受Fabhalta治疗后实现了不需要红细胞输注。在中国,该新药已被CDE纳入优先审评。
2.O药联合治疗UC获优先审评资格。百时美施贵宝PD-1抑制剂纳武利尤单抗(Opdivo,O药)联合顺铂化疗一线治疗不可切除或转移性尿路上皮癌(UC)的补充生物制品许可申请(sBLA)获FDA受理,FDA同时授予其优先审评,PDUFA日期为明年4月5日。在III期CheckMate-901研究中,与顺铂化疗方案相比,Opdivo与化疗联用显著改善患者的总生存期和无进展生存期;联合治疗具有良好的安全性,未发现新的安全性问题。
3.FRα-ADC卵巢癌sBLA获优先审评资格。FDA受理ImmunoGen公司靶向FRα的抗体偶联药物Elahere(mirvetuximab soravtansine)补充生物制品许可申请,该项申请寻求将Elahere的加速批准转换为完全批准,用于治疗叶酸受体α(FRα)阳性、铂类耐药的上皮性卵巢癌、输卵管癌或原发性腹膜癌患者。FDA同时授予其优先审评资格,PDUFA日期为明年4月5日。在Ⅲ期临床MIRASOL中,与化疗相比,Elahere联合治疗降低33%的死亡风险。
4.罗氏PI3Kα抑制剂乳腺癌Ⅲ期临床积极。罗氏旗下基因泰克PI3Kα小分子抑制剂Inavolisib联合CDK4/6抑制剂Ibrance(palbociclib)和氟维司群(fulvestrant)治疗局部晚期或转移性乳腺癌的Ⅲ期INAVO120研究达到主要终点。与palbociclib和氟维司群单药治疗相比,Inavolisib联合治疗显著改善患者无进展生存期;总生存期数据也显示改善趋势;inavolisib联合疗法耐受良好,未观察到新的安全性信号。
5.抑郁症精准疗法Ⅱ期临床结果积极。Alto Neuroscience公司在研疗法ALTO-300用于辅助治疗抑郁症(MDD)的Ⅱa期临床积极结果公布于ACNP2023年会上。该项试验旨在通过脑电图(EEG)生物标志物识别出ALTO-300抗MDD的潜力。第8周数据显示,通过生物标志物识别的患者与未显示生物标志物的患者组相比,患者MADRS评分持续改善(-17vs-12.3,p=0.002),更多的患者达到临床缓解(62%vs47%),药物总体耐受性良好。
6.辉瑞PROTAC组合乳腺癌早期临床积极。辉瑞与Arvinas公司开发的ER靶向PROTAC蛋白降解疗法vepdegestrant(ARV-471、PF-07850327)联合CDK4/6抑制剂Ibrance(palbociclib)治疗局部晚期或转移性、ER+/HER2-乳腺癌的Ⅰb期临床结果积极。在既往接受过中位4线治疗的患者中,这一组合的总缓解率达到42%,中位无进展生存期(PFS)为11.1个月。目前,辉瑞正在国际Ⅲ期临床(VERITAC-3)中评估ARV-471联合palbociclib对比来曲唑联合palbociclib,一线治疗ER+/HER2-、晚期乳腺癌的效果。
医药热点
1.郑明明任安徽省妇幼保健院执行院长。12月4日下午,安徽省妇幼保健院举行干部大会,宣布郑明明同志担任安徽省妇幼保健院执行院长的任职决定。郑明明,中共党员,主任医师,教授,研究生导师,医学博士,全国知名的妇产科(胎儿医学)专家,中国优生优育协会畸形早期干预专委会常务委员,中华医学会围产医学分会青年委员。
2.WHO:全球疟疾发病率下降28%。11月30日,世卫组织正式发布《世界疟疾报告2023》。《报告》显示,2022年,全球约有2.49亿例疟疾病例,比2021年增加500万例,比2019年新冠疫情暴发前的流行水平高出1600万例。2000年至2022年,全球疟疾发病率下降28%,死亡率下降50%,避免21亿例疟疾病例和1170万死亡病例。大部分被避免的疟疾病例(82%)和死亡病例(94%)发生在世卫组织非洲区域。
3.“杰青”向港澳开放。为进一步加大对港澳地区科技领军人才培养的支持力度,自然科学基金委将于2024年起向港澳地区依托单位开放国家杰出青年科学基金项目,同时将优秀青年科学基金项目(港澳)并入优秀青年科学基金项目,并继续开放青年科学基金项目。三类项目的申请条件、评审流程对于港澳和内地依托单位保持一致,同台竞争,择优资助。
评审动态
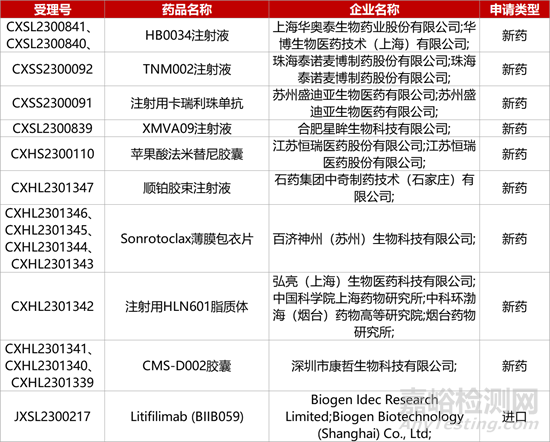
1. CDE新药受理情况(12月06日)
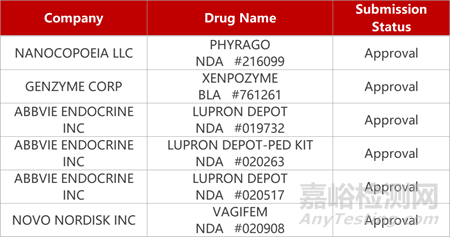
2. FDA新药获批情况(北美12月05日)