今日头条
全球首款CRISPR基因编辑疗法获批上市。Vertex公司与CRISPR公司开发的CRISPR/Cas9基因编辑疗法Casgevy(exa-cel)获FDA批准上市,用于治疗12岁及以上患有复发性血管闭塞危象(VOC)的镰刀型细胞贫血病(SCD)患者。该产品也是FDA批准的首款CRISPR基因编辑疗法。它利用CRISPR/Cas9基因编辑系统,在体外对来自患者的造血干细胞进行改造,使血红细胞生产高水平的胎儿血红蛋白(HbF)。目前全球同类产品至少11种疗法已进入临床阶段。
国内药讯
1.基石PD-L1单抗获批一线治疗食管鳞癌。基石药业PD-L1抗体择捷美(舒格利单抗注射液)获国家药监局(NMPA)批准新适应症,联合氟尿嘧啶类和铂类化疗药物一线治疗不可切除的局部晚期、复发或转移性食管鳞癌。在III期GEMSTONE-304研究中,与安慰剂联合化疗相比,舒格利单抗联合化疗显著改善BICR评估的无进展生存期(中位PFS:6.2个月vs5.4个月)和总生存期(中位OS:15.3个月vs11.5个月)。
2.默克口服c-Met抑制剂中国获批上市。默克c-Met抑制剂特泊替尼片(Tepotinib,拓得康)获国家药监局批准上市,用于治疗MET ex14跳跃突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。在关键II期VISION研究中,tepotinib单药在初治的组织活检阳性患者中的ORR为58.6%,mPFS为15.9个月,mOS为29.7个月;在经治组织活检阳性患者中的ORR为49.5 %,mPFS为11.5个月,mOS为20.4个月。
3.科伦博泰TROP2-ADC报产。科伦博泰TROP2靶向ADC创新药注射用SKB264的上市申请获CDE受理,用于治疗至少接受过2种系统治疗的不可切除的局部晚期或转移性三阴性乳腺癌。今年10月,该新药这一适应症申请已被CDE拟纳入优先审评。值得一提的是,该新药此前已被CDE纳入三项突破性疗法认定:局部晚期或转移性三阴乳腺癌和EGFR-TKI治疗失败的局部晚期或转移性EGFR突变非小细胞肺癌以及局部晚期或转移性HR+/HER2-乳腺癌。
4.先声口服SERD早期临床积极。先声药业旗下先声再明新型口服选择性雌激素受体降解剂(SERD)SCR-6852胶囊(SIM0270),在单药治疗HR+/HER2-晚期或转移性乳腺癌的Ⅰa期临床积极结果公布于SABCS会议上。在50例可评估患者中,SIM0270的客观缓解率(ORR)为8%;临床获益率为25%;大多数治疗期不良事件(TEAEs)为1-2级,最大耐受剂量(MTD)确定为每日200mg。仅有2例患者因为治疗相关AE停止治疗。
5.罗氏口服ATR抑制剂中国报IND。罗氏从Repare公司引进的口服ATR抑制剂camonsertib胶囊在中国递交IND申请并获得CDE受理。Camonsertib拟用于治疗具有特定合成致死基因组改变的肿瘤,包括 ATM(共济失调-毛细血管扩张突变)基因。在Ⅰ/Ⅱ期临床中,该药在晚期卵巢癌患者中的总缓解率达到25%。而camonsertib联合三种PARP抑制剂治疗伴有DNA损伤反应(DDR)改变的实体瘤的缓解率为13%;临床获益率(CBR)为49%。
6.赛诺菲TNFR1抑制剂中国报IND。赛诺菲1类化药SAR441566的临床试验申请获CDE受理。SAR441566是一款口服TNFR1抑制剂,通过扭曲可溶性TNFα三聚体的构象,阻断TNFα与TNFR1的相互作用,但该产品不会影响与细胞膜结合的TNFα的信号传导,可以更好降低感染风险并提高疗效。目前,SAR441566正在II期临床评估用于银屑病和类风湿性关节炎的治疗潜力。
国际药讯
1.蓝鸟SCD基因疗法获FDA批准上市。蓝鸟生物一次性基因疗法Lyfgenia(lovo-cel)获FDA批准上市,用于治疗12岁及以上患有镰刀型细胞贫血病(SCD)且有血管闭塞事件(VOE)史的患者。Lovo-cel旨在将改良形式的β-珠蛋白基因(βA-T87Q珠蛋白基因)的功能拷贝添加到患者自身的造血干细胞(HSCs)中,恢复其产生抗镰状血红蛋白(HbAT87Q)功能。蓝鸟生物此前已与诺华达成一项转让协议,在lovo-cel正式获FDA批准后,将以1.03亿美元的价格向诺华转让一张FDA优先审评券(PRV)。
2.辉瑞CD3/BCMA双抗获欧盟批准上市。辉瑞CD3/BCMA双抗ELREXFIO(elranatamab)获欧盟委员会(EC)批准上市,用于治疗复发或难治性多发性骨髓瘤(R/R MM)。在II期研究MagnetisMM-3(NCT04649359)研究中,中位随访为10.4个月时,elranatamab在既往至少接受过四种治疗的患者中达到61%的客观缓解率以及55%的非常好的部分缓解率。今年8月,该产品已获FDA加速批准上市,是继Tecvayli(teclistamab-cqyv,强生)后第二款在美获批的CD3/BCMA双抗。
3.非致幻性PTSD新药Ⅱ期临床积极。Transcend公司神经功能重塑因子TSND-201(methylone)治疗创伤后应激障碍(PTSD)的Ⅱ期临床IMPACT-1积极结果公布于ACNP年会上。TSND-201主要作用位点是单胺转运蛋白,对5HT-2a没有活性(即不会致幻)。6周治疗数据显示,TSND-201治疗的客观缓解率达到61.5%,受试者的DSM-5创伤后应激障碍量表(CAPS-5)得分与基线相比的平均变化为-36.2分(p<0.0001);TSND-201治疗总体耐受性良好。
4.再生元BCMA/CD3双抗早期临床积极。再生元BCMA/CD3双抗linvoseltamab治疗复发/难治性(R/R)多发性骨髓瘤(MM)的I/II期LINKER-MM1试验中期结果积极。中位随访为11个月时,独立审查委员会评估的linvoseltamab(200mg)的客观缓解率为71%,完全缓解率为46%;获得非常好的部分缓解(VGPR)的患者从每2周给药改为每4周给药。再生元计划今年向FDA递交生物制品许可(BLA)申请。
5.K药/仑伐替尼子宫内膜癌III期研究失败。默沙东PD-1抑制剂Keytruda(帕博利珠单抗)联合多受体酪氨酸激酶抑制剂Lenvima(仑伐替尼)一线治疗晚期或复发性子宫内膜癌的III期LEAP-001研究未达到主要终点。与化疗(卡铂+紫杉醇)相比,K药+仑伐替尼未能显著改善OS和PFS。安全性与该组合此前报道的研究一致。此前,FDA已批准该组合方案用于二线治疗非MSI-H/dMRR晚期子宫内膜癌患者。
医药热点
1.吕奔任中南大学湘雅二医院院长。12月8日,中南大学湘雅二医院召开全院干部职工大会,宣布中南大学干部任免决定:吕奔任湘雅二医院党委副书记、院长;因工作需要,校党委常委、副校长黎志宏不再兼湘雅二医院院长职务。吕奔院长在会议上作出四点承诺并表示将不负重托,与医院领导班子成员、广大干部职工一道,稳中求进,奋勇拼搏,共同推进医院高质量发展。
2.第十届“树兰医学奖”揭晓。12月9日,第十届“树兰医学奖”颁奖典礼在郑州市举行。本届“树兰医学奖”授予乔杰院士、高月教授和何建行教授,以表彰三位专家在医药卫生领域中取得突破性创新成果。李伟、吕奔、范骁辉、肖百龙、邵振华、陈罡、孙树洋、王奇慧、刘玮、胡明根、于晓、张俊华等12位青年医学科学家摘取“树兰医学青年奖”桂冠。
3.三部门发文规范公立医院成本核算。12月5日,国家卫健委发布关于印发《公立医院成本核算指导手册》的通知。按照通知安排,到2025年底,争取实现三级医院全部开展医疗服务项目成本核算、病种成本核算、DRG成本核算;二级及以下医院全部开展科室成本核算、诊次成本核算、床日成本核算,逐步开展医疗服务项目成本核算、病种成本核算、DRG成本核算。到2030年底,力争所有医院均开展上述成本核算工作。
评审动态
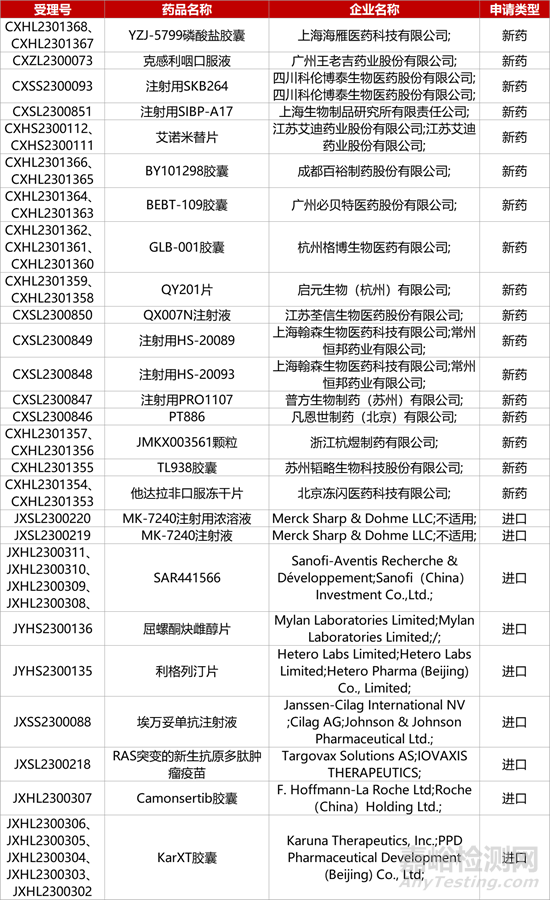
1. CDE新药受理情况(12月10日)
2. FDA新药获批情况(北美12月06日)