今日头条
睿健眼科iPSC获FDA孤儿药资格。睿健医药通用型iPSC(诱导多能干细胞)眼科细胞治疗产品NouvSight001获FDA授予孤儿药资格。这是该公司“AI+化学诱导”平台针对视网膜色素变性系列适应症开发的通用型细胞治疗产品。去年8月,“AI+化学诱导”平台首款通用型细胞疗法NouvNeu001已获CDE临床批件,拟开发用于治疗帕金森病(PD)。
国内药讯
1.恒瑞引进干眼症新药Ⅲ期临床见刊。恒瑞医药引进的环孢素滴眼液SHR8028(CyclASol,0.1%环孢菌素A制剂)治疗中国干眼患者(DED)的Ⅲ期研究成果公布于《美国医学会杂志》(JAMA)子刊JAMA Ophthalmology上。与溶剂相比,SHR8028可有效降低患者的全角膜荧光素染色(tCFS)评分,中央区CFS、总结膜丽思胺绿染色和视物模糊指标也优于溶剂,且药物安全性良好。目前,该新药上市申请正接受CDE审查。
2.德琪ADC启动国际II期临床。德琪医药靶向Claudin 18.2的抗体偶联药物(ADC)ATG-022在中国和澳大利亚启动评估单药治疗晚期或转移性实体瘤患者的II期CLINCH临床剂量扩展研究。ATG-022已取得初步疗效数据和安全性结果,该公司计划在剂量扩展阶段入组胃癌和其他实体瘤患者。去年5月,FDA已授予该新药用于治疗胰腺癌和胃癌两项孤儿药资格认定(ODD)。
3.北京伟德杰结肠炎新药获批IND。北京伟德杰生物自主开发的I类生物制品注射用VDJ010获国家药监局临床试验默示许可,临床适应症为溃疡性结肠炎(UC)。VDJ010是一款长效Treg激活剂,具备结构天然、高活性、用药剂量低、适应症范围广等潜在优势,在国际竞争格局中具备差异化的特点。伟德杰生物在该项目布局了4个国际专利。
4.康朴新型分子胶获批SLE临床。康朴生物E3泛素连接酶复合物CRL4-CRBN调节剂1类化药KPG-818胶囊获国家药监局临床许可,拟开发治疗系统性红斑狼疮(SLE)。KPG-818可高效降解锌指转录因子Aiolos(IKZF3)和Ikaros(IKZF1),能有效调节免疫细胞以及相关免疫细胞因子。在美国,该新药已完成用于治疗SLE患者的Ⅰb/Ⅱa期临床研究。
5.石药HER2 ADC报新IND。石药集团巨石生物开发的靶向HER2的ADC新药DP303c的临床试验申请获CDE受理。该新药目前已处于Ⅲ期临床开发阶段,正开展多项头对头临床研究,评估对比恩美曲妥珠单抗(T-DM1),以及对比曲妥珠单抗,用于治疗HER2阳性、晚期或转移性乳腺癌的有效性与安全性。除乳腺癌外,DP303c用于治疗胃癌、卵巢癌的相关研究也已进入II期临床阶段。
6.药明巨诺CAR-T商业化销售1.74亿元。药明巨诺发布2023年全年业绩报告,公司收入1.739亿元人民币,较去年的1.457亿元同比增加19.3%;研发投入4.08亿元,同比增长1.4%。目前,药明巨诺仅有瑞基奥仑赛注射液(商品名:瑞诺达)1款商业化产品,这是靶向CD19的CAR-T产品,已在国内获批用于治疗既往二线或以上系统性治疗的复发或难治性大B细胞淋巴瘤(LBCL),以及复发或难治性滤泡淋巴瘤(FL)。
国际药讯
1.武田白血病靶向药获批新适应症。武田第三代Bcr-abl激酶抑制剂ponatinib(Iclusig)获FDA加速批准新适应症,联合化疗一线治疗费城染色体阳性急性淋巴细胞白血病(Ph+ ALL)。在III期PhALLCON研究中,与伊马替尼相比,ponatinib联合化疗使患者获得微小残留病(MRD)阴性完全缓解的比例更高。此前,该药已被批准用于治疗TKI耐药或不耐受的慢性期、加速期或母细胞期慢性粒细胞白血病(CML)或Ph+ ALL患者,以及T315I阳性CML或Ph+ ALL患者。
2.O药联合治疗肝癌Ⅲ期临床积极。百时美施贵宝PD-1抑制剂Opdivo(nivolumab)联合CTLA-4靶向抗体Yervoy(ipilimumab)一线治疗晚期肝细胞癌(HCC)的Ⅲ期临床CheckMate-9DW达到主要终点。与研究者选择的索拉非尼或乐伐替尼单药治疗相比,Opdivo+Yervoy组合显著提高了患者的总生存期。临床中,该组合的安全性特征与已知研究数据一致,没有发现新的安全信号。
3.DMD新机制口服疗法Ⅲ期见刊。Italfarmaco公司新型口服组蛋白去乙酰化酶(HDAC)抑制剂givinostat治疗6岁以上仍具备行走能力的杜氏肌营养不良症(DMD)男童的Ⅲ期临床EPIDYS达到主要终点。第72周时,与安慰剂相比,givinostat联合皮质类固醇治疗显著延缓了疾病进展,患者攀爬四级楼梯的衰退速度较安慰剂组更慢(与安慰剂的差异为1.78秒,p=0.037)。详细结果发表在The Lancet Neurology期刊上。
4.体内CRISPR基因编辑疗法上Ⅲ期临床。Intellia公司CRISPR/Cas9基因编辑疗法NTLA-2001治疗转甲状腺素蛋白淀粉样变性伴心肌病(ATTR-CM)的Ⅲ期MAGNITUDE试验完成首例患者给药。NTLA-2001是基于Intellia专有的非病毒平台开发,利用脂质纳米颗粒向肝脏输送靶向TTR基因的特异性gRNA和编码Cas9酶的mRNA,具有ATTR功能治愈性潜力。在Ⅰ期临床中,单次注射NTLA-2001可将患者血清中的转甲状腺素(TTR)蛋白降低约90%,且疗效维持6-12个月。
5.全球首款结核病疫苗启动Ⅲ期临床。葛兰素史克与Aeras公司和国际艾滋病疫苗行动组织(IAVI)共同开发的结核病(TB)候选疫苗M72/AS01E启动Ⅲ期临床,在受结核病影响严重的南非开展首批疫苗接种,评估用于预防结核病的有效性。M72有望成为首款为青少年和成人预防最常见的肺结核的疫苗。该项试验由惠康基金会(Wellcome)和比尔及梅琳达·盖茨基金会提供资金,盖茨医学研究所负责开展。
6.优瑞科T细胞疗法早期临床积极。优瑞科生物(Eureka Therapeutics)宣布其T细胞疗法ECT204已在用于治疗GPC3阳性晚期肝细胞癌(HCC)的Ⅰ/Ⅱ期临床ARYA-3取得了安全性数据和初步疗效结果,目前正进行第二阶段患者招募。在这项研究中,患者的T细胞被收集并经过基因修改,以表达优瑞科专有的抗GPC3 ARTEMIS T细胞受体(AbTCR)。此前,FDA已授予ECT204用于治疗HCC的孤儿药资格。
7.Capstan公司完成B轮融资。Capstan公司宣布完成1.75亿美元的超额认购B轮融资,用于推进其体内嵌合抗原受体T细胞(CAR-T)候选疗法CPTX2309开展用于治疗自身免疫疾病的早期概念验证研究,以及进一步开发靶向脂质纳米颗粒(tLNP)管线。此轮融资由RA Capital Management领投,新投资者包括Forbion、强生创新(JJDC)等,现有投资者Alexandria Venture Investments、百时美施贵宝、礼来公司、拜耳旗下的Leaps也参投。
医药热点
1.“16+8”饮食或增加心脏病风险。据美国《华盛顿邮报》18日报道,一项新研究发现,每天仅在8小时内完成全天的进食的成年人死于心脏病或中风的可能性是将进食分散在12—16小时的人的两倍左右,而且不会延年益寿。与不禁食的人相比,选择每天8小时之外禁食的人的肌肉质量较低。吃得太少或禁食时间太长,会导致增肌或维持肌肉含量变得更加困难,而肌肉含量的减少增加了患心血管疾病死亡的风险。
2.拜耳调整制药业务管理团队。3月20日,拜耳宣布其制药业务部执行领导团队将进行重组。据Endpoints News和Fierce Pharma报道,制药领导团的高管人数将从14人减少至8人,其中全球营销主管Anne-Grethe Mortensen、放射学主管Gerd Kruger和消费者健康部门负责人Heiko Schipper将离开公司。此外,拜耳还新成立了一个新的“全球商业化”部门,该部门将包括公司前战略业务单元肿瘤学、全球营销、数字与商业创新的主要部分,以及医疗事务与药物警戒的部分,由Christine Roth领导。
3.医师电子化信息管理文件出台。3月19日,国家卫健委发布《关于进一步推进医师电子化信息管理工作的通知》,明确了各级卫生健康行政部门进一步推进医师电子化信息管理工作的具体措施和要求。《通知》强调继续并行使用医师电子证照和现行证照,明确两者具有同等效力。鼓励地方不断拓展电子证照应用场景,鼓励医师通过医师电子化注册系统电脑端、手机端办理相关业务,优化政务服务,提升管理水平。
评审动态
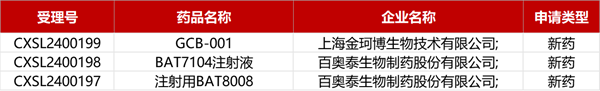
1. CDE新药受理情况(03月21日)
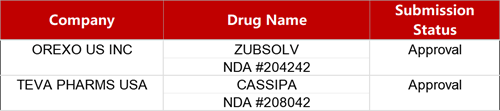
2. FDA新药获批情况(北美03月20日)