今日头条
远大引进核药获批III期临床。远大医药从Isotope公司引进的创新放射性核素偶联药物(RDC)ITM-11获国家药监局批准开展国际III期临床(COMPOSE,NCT04919226),评估用于治疗胃肠胰腺神经内分泌瘤(GEP-NETs)的有效性与安全性。ITM-11将无载体177Lu与生长抑素类似物偶联,通过与GEP-NETs表面高水平表达的生长抑素受体(SSTR)结合靶向杀伤肿瘤细胞。远大医药在抗肿瘤核药方面已有4款RDC获批开展临床研究。
国内药讯
1.亿帆升白药获批欧盟上市。亿帆医药第三代长效粒细胞集落刺激因子(G-CSF-Fc融合蛋白)创新生物药Ryzneuta(艾贝格司亭α注射液,F-627)获欧盟委员会(EC)批准上市,用于预防肿瘤患者在化疗过程中引起的嗜中性粒细胞减少症(CIN)。临床数据显示,F-627在与长效原研产品、短效原研产品开展的头对头临床研究中均达到了预设标准。该产品已获得FDA和CDE批准上市。
2.万泰「九价HPV疫苗」启动Ⅲ期临床。厦门万泰沧海重组人乳头瘤病毒九价疫苗(大肠埃希菌)登记启动一项Ⅲ期临床,适应症为“预防人乳头瘤病毒HPV6和HPV11感染及因此引发的尖锐湿疣等疾病和人乳头瘤病毒HPV16、HPV18、HPV31、HPV33、HPV45、HPV52、HPV58感染及因此引发的宫颈癌等疾病”。该项试验由湖北省疾控中心杨北方博士负责,计划在中国18~26周岁女性中评估该疫苗工艺放大后的免疫原性及安全性。
3.安进肺癌双抗启动中国Ⅲ期临床。安进与百济神州联合开发的DLL3/CD3双抗Tarlatamab登记启动一项国际(含中国)Ⅲ期临床(DeLLphi-306),拟评价用于治疗同步放化疗后未进展、局限期小细胞肺癌(LS-SCLC)患者的有效性和安全性。该项试验中国主要研究者为华中科技大学同济医学院附属同济医院褚倩主任医师。去年年底,FDA已受理该新药的上市申请,并同时授予其优先审评资格,用于治疗化疗耐药的晚期SCLC。
4.靖因siRNA药物启动临床。靖因药业特异性肝靶向PCSK9小核酸药物SRSD101注射液在Ⅰ期临床中完成全部受试者入组给药。SRSD101通过阻断PCSK9的蛋白合成,从而增强肝细胞摄取LDL-C能力,以实现降血脂的作用。在临床前研究中,SRSD101显示出了强效持久降脂的疗效和良好的安全性,有望为原发性高胆固醇血症患者提供新的治疗选择。
5.贝达实体瘤双效抑制剂获批IND。贝达药业1类化药BPI-221351片获国家药监局临床试验默示许可,拟开发用于IDH1和/或IDH2突变的晚期实体瘤患者,包括但不限于胶质瘤、胆管癌等。BPI-221351是一款高脑渗透性、突变型异柠檬酸脱氢酶IDH1/IDH2双效抑制剂。BPI-221351可特异性结合突变型IDH1和IDH2的变构位点,抑制突变型的IDH酶催化α-KG生成2-羟戊二酸的过程,从而抑制肿瘤的进展。
6.凡恩世胰腺癌双抗获快速通道资格。凡恩世制药靶向Claudin18.2/CD47双特异性抗体PT886获FDA授予快速通道资格,用于治疗转移性Claudin 18.2阳性胰腺癌患者。PT886可通过巨噬细胞的ADCP活性和NK细胞的ADCC活性直接杀伤肿瘤细胞,并通过同时靶向肿瘤细胞表面高表达的Claudin 18.2和CD47扩大肿瘤杀伤范围。此前,FDA已授予该新药用于治疗胰腺癌的孤儿药资格。
国际药讯
1.首个DMD非甾体类药物获批上市。Italfarmaco公司新型口服HDAC抑制剂givinostat(Duvyzat)获FDA批准上市,成为用于治疗六岁及以上杜氏肌营养不良(DMD)患者的首个非甾体类药物。III期EPIDYS试验18个月数据显示,与安慰剂相比,Duvyzat治疗患者爬四级楼梯所需时间更少(1.25秒vs3.03秒);门诊评估量表(NSAA)得分、起立时间、肌肉力量等次要终点指标也显著改善。最新数据日前发表在The Lancet Neurology期刊上。
2.奥希替尼联合治疗肺癌Ⅲ期临床积极。阿斯利康EGFR-TKI抑制剂Tagrisso(奥希替尼)联合化疗一线治疗局部晚期或转移性非小细胞肺癌(NSCLC)患者的Ⅲ期FLAURA2临床结果积极。该项试验此前已达到主要终点,Tagrisso联合化疗较Tagrisso单药将疾病进展或死亡风险降低38%(HR:0.62;95% CI:0.49-0.79;p<0.0001)。最新的两年随访数据显示,Tagrisso联合治疗患者的总生存期(OS)数据也具改善趋势,详细结果将公布于ELCC2024年会上。
3.HPV疫苗联用PD-L1最新数据积极。Nykode公司癌症疫苗VB10.16联合罗氏PD-L1抑制剂atezolizumab治疗复发或转移性人类乳头瘤病毒16型(HPV16)阳性宫颈癌患者的Ⅱ期临床两年随访结果积极。在中位随访为6个月时,VB10.16组合的客观缓解率(ORR)为21%,疾病控制率(DCR)达到64%。最新数据显示,组合疗法与单药免疫检查点抑制剂治疗的历史对照相比,支持VB10.16与atezolizumab之间具有协同作用。详细数据将在医学会议上公布。
4.Cabaletta Bio公司CAR-T获孤儿药资格。Cabaletta Bio公司CAR-T产品CABA-201获FDA授予孤儿药资格(ODD),用于治疗系统性硬化症(SSc)。这是一款基于驯鹿生物全人源CD19序列开发的CAR-T疗法,拟开发用于治疗B细胞驱动的自身免疫性疾病,包括系统性红斑狼疮(SLE)、类风湿性关节炎、肌炎和系统性硬化症等。去年5月,该产品已获得FDA快速通道资格,用于治疗SLE和狼疮肾炎(LN)患者。
5.致命心脏病基因疗法临床前研究见刊。Tenaya公司基因疗法TN-401治疗PKP2突变、心律失常性右室心肌病(ARVC)的临床前研究成果已发表在《自然》杂志子刊Communications Medicine上。TN-401旨在通过AAV9将PKP2基因的功能拷贝靶向递送至心肌细胞,来恢复PKP2蛋白的产生。结果显示,敲除PKP2基因的小鼠在接受TN-401治疗后,其中位寿命至少达到58周(安慰剂为4.7周)。TN-401预计于今年下半年进入临床开发,进行首位患者给药。
6.艾伯维布局新型炎症性肠病新药。艾伯维与Parvus公司将利用后者专有Navacim调节性T细胞(Treg)免疫耐受技术平台,合作开发新型炎症性肠病(IBD)候选疗法。Navacims将多价肽-主要组织相容性复合物(肽-MHCs)递呈给T细胞,从而引发T细胞内源性扩增并分化成为抗原特异性Tregs。根据协议,Parvus公司将获得预付款,以及合作产品的开发和商业里程碑潜在款项。
医药热点
1.南方医科大学新添一家直属附属医院。3月23日,深圳市坪山区与南方医科大学签署《深圳市坪山区人民政府南方医科大学关于共建南方医科大学坪山医院的协议》。根据《共建协议》,依托深圳市坪山区人民医院迁址项目,双方共建“南方医科大学坪山医院”,作为南方医科大学直属附属医院。目前,坪山区人民医院迁址重建项目正加快建设中,该项目是坪山区重点建设的民生项目,建成后将成为2000张床位新院区,定位为“深圳东部国际化医疗中心”。
2.广东新生儿出生即可办医保。3月22日,广东省医保局发布《关于做好新生儿医疗保障的通知》,明确新生儿监护人可凭新生儿出生医学证明,在新生儿出生后180天内在全省任一统筹地区办理城乡居民基本医疗保险参保缴费,不受户籍地或者居住地限制,不需要提供户口簿或居住证明。该通知明确,自新生儿出生之日起所发生的符合规定的医疗费用,均纳入医保报销范围。
3.小林制药紧急召回含红曲成分保健品。 据日本时事通讯社24日报道,日本制药巨头小林制药公司22日以可能危害人体健康为由,紧急召回该公司生产的约30万份含有红曲成分的保健品。今年1月起,小林制药已陆续收到13名消费者在服用相关产品后身体出现肾脏疾病,其中有6人住院治疗,有的患者甚至还需要进行透析。为防止更多消费者健康受损,该公司呼吁消费者立即停止服用。日本宝酒造公司24日也发布消息称,因该公司生产的一款酒使用了由小林制药提供的红曲原料,决定召回市场上约10万瓶酒。
评审动态
1. CDE新药受理情况(03月24日)
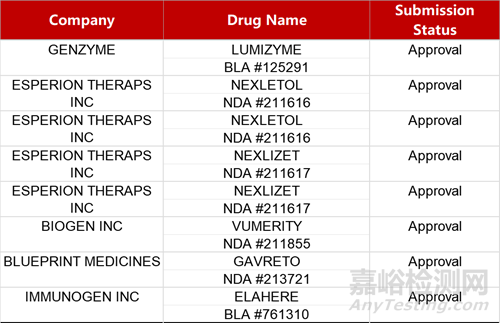
2. FDA新药获批情况(北美03月22日)