您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-06-12 08:57
新冠爆发催生了新冠疫苗研发的火热,随着而来的是非人灵长类动物(NHPs)供应的短时暴涨。再加上国内禁止向美国出口NHPs,而国内占据美国猴进口的70%,直接导致美国NHPs动物严重紧缺。另外,从动物“3R”原则考虑,也需要尽可能减少NHPs的使用。国内NHPs供应虽然比美国要好上不少,但毕竟价格居高不下,非临床安评研究中也需要合理设置动物数量。FDA及美国工业界在减少NHPs方面的策略和思考可以参考一下。
很多生物药物、寡核苷酸和基因治疗药物的非临床安全性评价唯一相关的非啮齿类动物就是猴,有些小分子化药也是选择猴作为相关动物种属。猴不仅在人体安全性预测方面发挥重要作用,在有效性方面也有很高的临床相关性。这也使很多药企对猴形成一种偏爱,无论大分子还是小分子,能用猴尽量用猴,毕竟猴在靶点生物学作用、药理学作用、药代动力学行为等方面与人体最为接近。不过,梳理下已经上市的10款抗肿瘤多靶点酪氨酸激酶抑制剂(dasatinib、nilotinib、cabozantinib、bosutinib、vandetinib、sunitinib、axitinib、 pazaponib、regorafenib、sorafenib),其中6款采用犬作为非啮齿类研究种属,3款采用食蟹猴,1款同时用了犬和猴。结果显示大部分药物不仅犬和猴之间的毒理学发现重叠,啮齿类和非啮齿类动物之间的毒理学表现也类似。如果回顾下5款已上市的JAK抑制剂(baricitinib、abrocitinib、ruxolitinib、tofacitinib、 upadacitinib)的非临床毒理学发现,也能得出类似的结论。所以,对于小分子,很多情况下,猴可以由犬进行替代。即使是生物药,根据ICHS6 R1要求,如果啮齿类和非啮齿类动物短期重复给药毒性试验中毒性表现类似,更长周期毒理研究中可以选择单一种属,且啮齿类动物优先,某种程度上也有减少NHPs使用的空间。
那么如果确定采用NHPs开展一般毒理研究,还有哪些策略可以减少动物使用呢?FDA、Eli Lilly、Gilead、Genentech、Seagen、Merck、Roche、Pfizer、Amgen、Incyte等团队围绕5点展开了讨论,分别是:1)单一性别动物的使用;2)不设置对照组;3)不设置恢复期动物;4)减少给药组数;5)不同给药途径合并在同一项试验中开展研究。
先看一下NHPs重复给药毒性试验的经典设计方案,如下表所示。比较常用的设计是1组对照,3组给药,每组10只,雌雄各半,6只主研究组,4只恢复期组。当然,有些试验可能仅在对照组和高剂量组设置恢复期,动物数相对就少一些。不过,无论出于注册风险,还是其它方面的考量,主流做法还是以40只的设计方案为主。
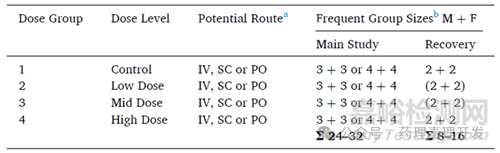
单一性别使用:通常来讲,如果适应症仅针对单一性别,可以考虑采用单性别动物开展一般毒理研究。但单一性别动物并不能导致动物数量的明显减少。关于这点,在ICH M3(R2) Q&A(R2)中也有提及,对于单性别适应症,如果采用单一性别动物开展研究,每组动物数量应该增加。主要考虑到很多毒性其实并没有性别差异,对于这类毒性,双性别10只/组,减为单性别的5只/组,并不合理。但无论如何,动物数量是有可能比双性别少一些的,建议开展试验之前,先与监管机构达成一致。
不设置对照组:关于这点,之前写过一篇专门的文章讨论历史对照代替平行对照的问题,有兴趣可自行翻阅。此处,FDA及工业界再次就该问题进行了讨论。毕竟非啮齿类动物大部分毒理学终点有充分的给药前数据,再结合历史对照数据,有没有可能减少对照组的使用。研究团队认为可能会面临一些挑战,也有很多变量不太可控,比如动物来源、年龄、对照溶媒的使用、历史对照数据库的维护等等。毕竟,不同动物来源、不同年龄,对应的各种背景数据会有区别。不同药物使用的溶媒也有不同,有些溶媒也不一定有充分的背景数据可用。最后讨论的结果是,有些场景可以考虑不设置对照组,比如两项同时开展的研究共用1组阴性对照或者仅用于研究药物局部毒性的情况。
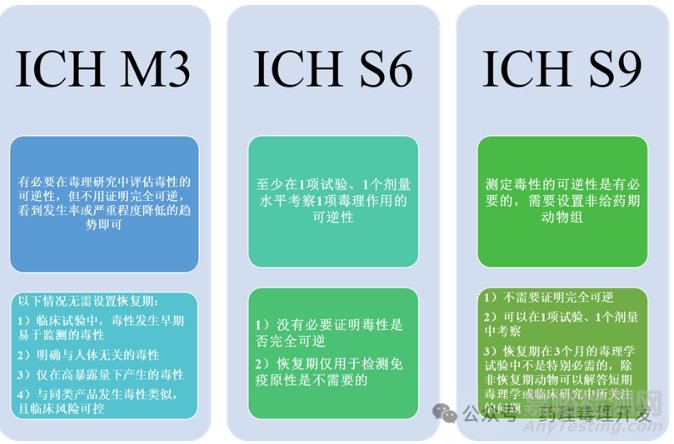
不设置恢复期组:关于恢复期动物设置的问题,之前也撰写过专题文章,有兴趣可翻阅。其实,ICH指南中对于恢复期的设置已经有多处进行了讨论,简单总结在下图之中。恢复期动物设置这个角度确实可以节约NHPs的使用。
减少给药组数:传统组别设计是1个vehicle对照+3组给药组。研究小组认为,对于高度靶向的生物药物,如果前期已经有短期非临床研究数据,后续更长周期毒理研究可以考虑将3组给药组减为2组。比如MOA非常明确的单抗产品,短期给药毒性试验未见明显的供试品相关的毒性反应,药理作用也已经饱和,且与临床拟用暴露量之间有充分的安全窗口,更长周期毒理试验可以考虑缩减供试品组别。但对于小分子药物就会面临很多挑战,小分子特异性普遍不好,绝大多数会出现脱靶毒性,而更长周期给药可能会增加脱靶毒性的发生率和严重程度。还有些场景,比如药物的治疗窗口很窄,很难实现3个剂量水平设置,比如高剂量给药可行性问题等,但这类情况并不多见,需要说明其合理性。
合并两种给药途径:很多生物药物会开发IV和SC两种给药途径。FDA认为两种途径之间的系统毒性表现通常没有本质区别。对于这类药物的开发,可以考虑将两种给药途径合并在一项毒理研究中考察。一种可参考的组别设计是Vehicle对照(IV+SC)、2组IV给药组、1组SC给药组。还有一种思路是仅在NHPs中考察IV给药毒性,在啮齿类或兔子中考察SC给药局部耐受性(即使这些动物不是相关种属)。不过,第二种思路并不常见,而且前提是NHPs动物经SC给药不产生该途径特异的药理学作用。第三种策略是短期毒理研究IV给药,更长周期毒理试验采用SC给药。
NHPs生殖和发育毒性研究(DART)
FDA公布了一组数字,2015-2020年生物药BLA中的DART研究中,2/3未包含NHPs的胚胎发育毒性试验(EFD)或增强的围产期毒性试验(ePPND)。其中,28%递交的啮齿类和兔子EFD/PPND试验数据;23%基于证据权重分析(WoE)提示有生殖毒性风险;10%基于WoE分析提示无生殖毒性风险;3%采用有啮齿类动物活性的替代分子开展的研究;3%采用转基因动物开展的研究。不过,也还是有1/3比例的BLA采用NHPs开展了DART试验,这其中,非肿瘤项目占了87%。另外,绝大多数肿瘤药物(75%)DART部分是提交的WoE分析资料。非肿瘤药物也有仅通过WoE获批的,但占比不高,仅有16%。FDA与工业界代表就WoE能否完全替代具体试验进行了讨论,认为对于新靶点、新的分子形式WoE的使用是受限的。另外,监管机构之间对于WoE的接受程度不同,FDA接受并不代表美国以外的其他药品监管机构同样会接受。另外,对于能否用一些其他试验系统比如大鼠胚胎细胞、胚胎干细胞、斑马鱼等替代NHPs,讨论小组一致认为用于候选分子筛选或小分子探索性研究可以,现阶段还不具备替代可能。
另外一个常见思路是替代分子使用和靶点人源化转基因动物的使用。这两种方案用于DART试验之前都需要回答一个问题,即药理学相关性,比如替代分子与对应靶点的生物学作用、转基因模型是否进行了充分的表征等。已经有包括TNFα抗体certolizumab、CD11a抗体efalizumab、CD4抗体keliximab采用以上路径完成了DART研究,前两个药物采用的替代分子形式,后一个药物采用的转基因动物模型。
最后
合理减少NHPs的使用既是遵循“3R”原则,也是为了降低药物开发成本,但并不能以牺牲科学性为代价。FDA与美国工业界这次讨论也是围绕科学、合理减少NHPs使用展开。如果犬、小型猪等其它非啮齿类动物能实现目的,可以不采用NHPs。如果短期毒理研究NHPs和啮齿类动物毒性表现相似,更长周期可以采用NHPs。当然,对于一定要采用NHPs开展毒理研究的情况,也可以从单一性别动物使用、对照组设置、恢复期动物设置、给药组数优化、不同给药途径合并等角度进行思考,优化动物使用数量。对于NHPs开展的DART研究,既需要重视WoE价值,也可以考虑替代分子或转基因模型的可行性。最后,动物数量是毒理研究中的一个敏感话题,挑战传统设计可能会引入一些风险,与监管机构的充分沟通也很有必要。

来源:药理毒理开发


