您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2024-06-13 09:01
在药品研发注册工作中经常遇到各国药典对同一产品的溶解度和贮藏条件的规定不甚相同,这里总结对比一下几个主流国家药典现行版的凡例/通则对溶解度和贮藏条件的相关规定和描述,供大家参考备用。不足之处,还请多多指教。
1.溶解度Solubility
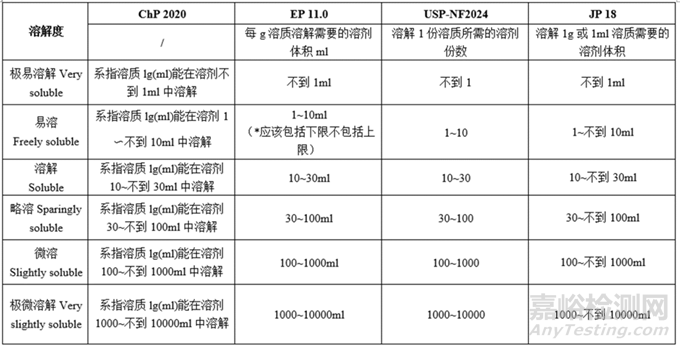
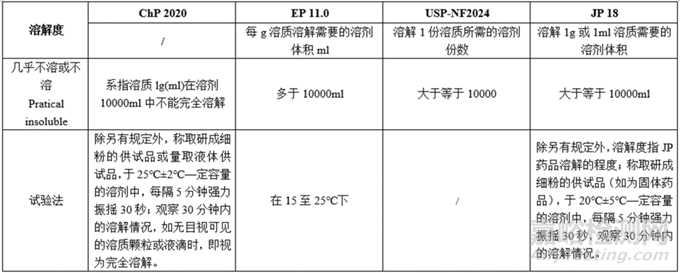
小结:各国药典对各溶解度的描述所用词汇均一致;各项溶解度对应的需要的溶剂体积基本一致;试验法,ChP、EP、JP的操作温度略有不同,USP未说明溶解度的试验法。
2.贮藏条件及定义(温度/光照/容器密闭情况等)
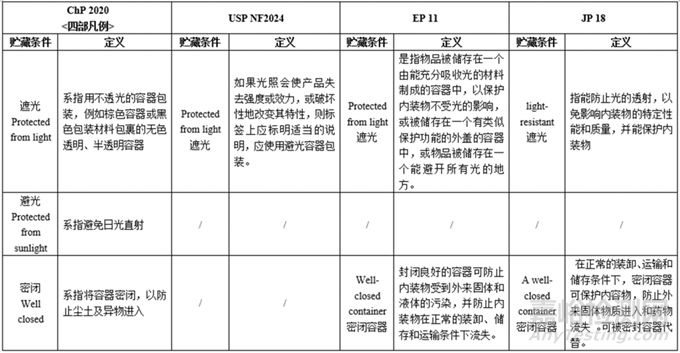
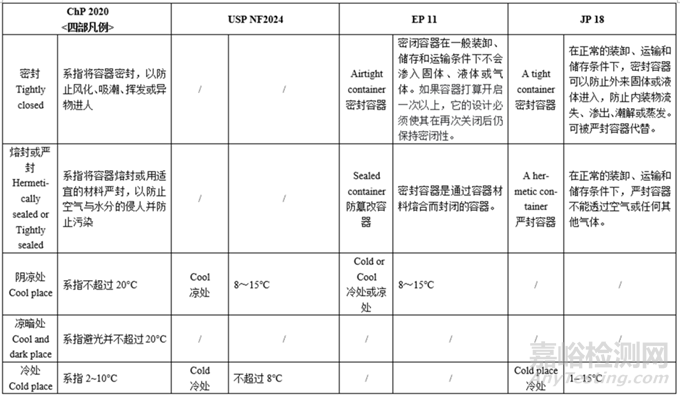
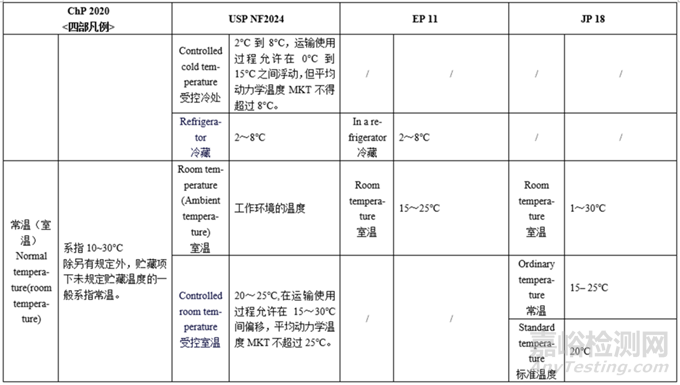
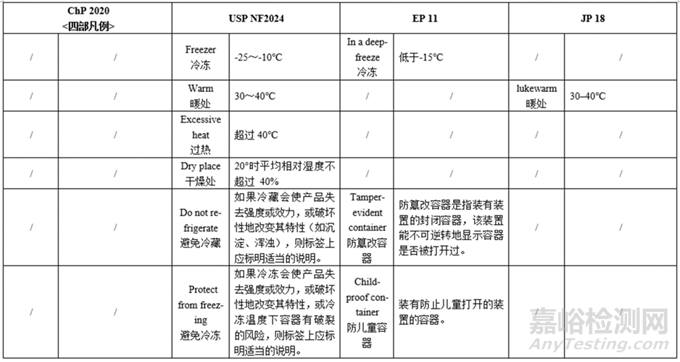
备注:上表中国外药典的各项定义仅为部分摘要,完整内容请见药典原文。
小结:各国药典凡例/通则的贮藏条件均不同:
光照—只有ChP有避光,其余药典仅提及遮光(Protected from light)。
温度—各国药典对各种温度的划分不同,规定范围也不大相同,其中USP对温度的划分类别最多、定义描述最为详细;JP的室温和常温不同,分别为1~30℃、15–25℃,中国药典的室温和常温一致,EP、USP仅有室温。
容器密闭—各国药典对容器密闭情况的分类基本一致(密闭/密封/严封/熔封),描述所用的词汇略有不同(e.g.密封Tightly closed/Airtight),定义基本一致。
参考文献:
1. 中国药典2020版四部凡例(中文版、英文版)
2. 美国药典USP NF-2024 General Notices 、<659 PACKAGING AND STORAGE REQUIREMENTS >
3. 欧洲药典EP 11 <5.11. CHARACTERS SECTION IN MONOGRAPHS >、<General notices 1>、< 3.2. CONTAINERS>
4. 日本药典JP 18 <General Notices30、16、43-46>

来源:Internet


