您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-06-20 08:42
医疗器械的环氧乙烷(Ethylene Oxide, EO)灭菌是一种广泛使用的低温灭菌方法,特别适合那些不能耐受高温或湿润环境的医疗器械。环氧乙烷灭菌确认是一个确保灭菌过程有效性和安全性的重要步骤,尤其是在产品的设计开发中很重要。
第一部分:环氧乙烷的介绍
环氧乙烷(Ethylene Oxide, EO)是一种含有氧杂原子的三元杂环化合物,化学式为C2H4O,也被称作氧化乙烯。它是一种无色的易燃气体,在低温下是无色透明的液体,具有高蒸汽压,因此具有较好的穿透力。环氧乙烷的熔点为-111℃,沸点为13.2℃,相对密度为0.8824(10/10℃),并且它能够溶于水和多种有机溶剂,如乙醇、乙醚等。
环氧乙烷的化学性质非常活泼,能与多种亲核试剂如水、醇和胺等发生反应,开环生成相应的乙二醇、醇醚和羟基胺等化合物。
环氧乙烷还具有消毒和灭菌的能力,能够杀灭多种细菌、病毒等微生物,因此在医学和工业领域作为消毒剂和灭菌剂有着广泛的应用。例如,它可以用于消毒医疗用品,如绷带、缝线和手术器具。然而,环氧乙烷也具有毒性,是一种可疑的人类致癌物,因此在处理时需要采取适当的安全措施。
是在产品的设计开发中很重要。
第二部分:环氧乙烷灭菌原理

环氧乙烷灭菌是一种有效的低温灭菌方法,其原理主要包括以下几个方面:
烷基化作用:环氧乙烷与微生物体内的蛋白质、DNA和RNA发生非特异性烷基化作用。这种作用可以与蛋白质上的游离羧基(-COOH)、氨基(-NH2)、硫氢基(-SH)和羟基(-OH)发生反应,导致蛋白质失去其反应基团,阻碍了微生物的正常化学反应和新陈代谢,从而导致微生物死亡。
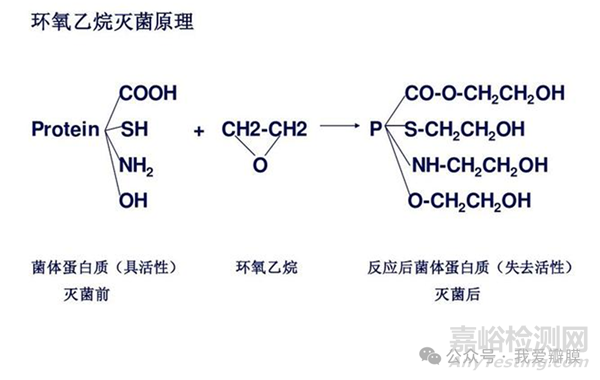
抑制生物酶活性:环氧乙烷能抑制微生物多种酶的活性,例如磷酸脱氢酶、胆碱酯活酶及其他氧化酶等,阻碍了微生物正常代谢过程的完成,导致其死亡。
渗透作用:环氧乙烷具有较好的渗透能力,可以穿透形态不规则物品并达到灭菌效果。
温度和湿度的影响:灭菌过程通常在一定的温度和湿度条件下进行,以确保环氧乙烷气体与微生物充分作用。
灭菌过程:包括预处理、装载、抽真空、注入环氧乙烷气体、维持一定条件、通风和后处理等步骤,确保环氧乙烷气体均匀分布并有效杀灭微生物。
环氧乙烷是一种广谱的灭菌剂,能够杀灭包括细菌、真菌、病毒和芽孢在内的所有微生物。灭菌过程需要严格控制,以确保灭菌效果和安全性。
第三部分:环氧乙烷灭菌确认参考标准
环氧乙烷灭菌的核心标准是GB18279和 ISO11135,具体如下:
GB 18279.1-2015 医疗保健产品 环氧乙烷 第1部分:医疗器械灭菌过程的开发、确认和常规控制的要求(ISO 11135-1:2007,IDT),
ISO标准最新版为ISO 11135:2014
GB 18279.2-2015 医疗保健产品 环氧乙烷 第2部分:GB18279.1应用指南(ISO /TS 11135-2:2008 ,IDT)
系列行业标准可以参考,常用的有以下几个:
YY/T 1302.1-2015 环氧乙烷灭菌的物理和微生物性能要求 第1部分:物理要求
YY/T 1302.1-2015 为环氧乙烷灭菌设备、预处理、计算相对湿度、环氧乙烷浓度、可燃性和在过程等效的统计学应用提供指导;
YY/T 1302.2-2015 环氧乙烷灭菌的物理和微生物性能要求 第2部分:微生物要求
YY/T 1302.2-2015 旨在解决环氧乙烷灭菌过程的开发和确认中的各种微生物方面问题,如关于灭菌过程定义的各种微生物方法;微生物过程挑战装置;在灭菌确认中的微生物性能鉴定(MPQ);过程有效性维护中的微生物实验可能存在的问题等;
YY/T 1267-2015 适用于环氧乙烷灭菌的医疗器械的材料评价
YY/T 1267-2015 为产品设计阶段的材料选择提供了依据;
YY/T 1268-2015 环氧乙烷灭菌的产品追加和过程等效
YY/T 1268-2015 适用于医疗器械环氧乙烷灭菌的以下几种情况:a)在已经确认的环氧乙烷灭菌过程中增加新产品b)评估已确认产品的变更c)已确认的过程转移到不同的场地或设备d)评估灭菌过程的等效性
第四部分:环氧乙烷灭菌过程

最常见的为过度灭活法
半周期法:总共运行三次连续的试验,结果为生物指示物全部灭活(菌量不少于106,以确认最小暴露时间。规定的暴露时间应至少为此最小时间的两倍。同时应运行有存活微生物的短时周期,以证明恢复技术的充分性。
步骤:
•识别最难灭菌产品或过程挑战装置,该过程挑战装置与预期处理的最难灭菌部分同样的难灭菌。
•确定产品中最难达到灭菌条件的位置。
•通过以下方法之一创建含有已知微生物数量和已知对环氧乙烷抗力的灭菌过程挑战
•a) 将生物指示物放置于产品中最难达到灭菌条件的位置,或放置于过程挑战装置中
•b) 将适当的参考微生物接种于产品中最难达到灭菌条件的位置。
•将按照上述方式创建的挑战装置使用与常规生产的产品相同的方法进行包装,并放置于灭菌负载中。
•将灭菌负载暴露于相比规定灭菌过程具有较低杀灭率的环氧乙烧条件下。
•若根据确认了已知微生物数量的灭活,考虑所需的无菌保证水平,推算一个微生物存活的给定概率,确定灭菌过程的处理程度。
灭菌剂的选择和浓度:
环氧乙烷是一种有效的灭菌剂,但需要在适当的浓度下使用以确保灭菌效果。

灭菌周期的确定:
灭菌周期包括预湿、曝气、扩散、灭菌、后曝气和解析等步骤,每个步骤的时间和条件都需要根据产品特性和灭菌设备进行优化。
温度和湿度的控制:
环氧乙烷灭菌通常在较低的温度下进行,以避免对热敏感的医疗器械造成损害。湿度的控制也对灭菌效果有重要影响。
灭菌器的验证:
灭菌器需要进行严格的验证,包括物理参数的监测、生物指示剂的使用等,以确保灭菌过程的一致性和可重复性。
生物指示剂的使用:
生物指示剂用于评估灭菌过程的有效性,通常选用对环氧乙烷有抵抗力的细菌孢子。
化学指示剂的使用:
化学指示剂可以提供灭菌过程中温度、湿度和时间等条件的记录。
解析时间的确定:
解析是指灭菌后让环氧乙烷从医疗器械中挥发出去的过程。解析时间的长短取决于医疗器械的材料、灭菌剂的浓度和灭菌后的存储条件。
残留量的检测:
灭菌后医疗器械上可能会有环氧乙烷残留,需要通过检测来确保残留量低于安全标准。
无菌保证水平(SAL)的评估:
无菌保证水平是灭菌过程的一个重要指标,表示单位产品上存在活微生物的概率。
法规和标准的遵循:
灭菌确认过程需要遵循相关的法规和标准,如ISO 11135等,确保灭菌过程的合规性。
第四部分:环氧乙烷灭菌效果的主要因素
温度:在密闭空间内,温度升高可使气体分子活动加剧,有利于EO分子渗透到本来难以到达的部位从而提高环氧乙烷的灭菌效率,据测算,温度每升高10℃,芽孢杀灭率提高1倍。然而,在超过一定温度以后,灭菌效率上升不明显,且过高的温度也可能对产品造成损害,因此灭菌温度的常规极限通常在37℃-63℃,一般常用的合适温度为50℃±5℃。
湿度:灭菌产品的含水量、微生物本身的干燥程度和灭菌环境的相对湿度,对EO的灭菌作用均有显著影响。应保证灭菌室加湿效果具有在相对湿度≤40%时加湿到75%以上的能力;在抽真空后、加药前,此时灭菌器内的湿度应控制30%-80%RH范围内。
EO浓度:在一定温度和湿度条件下,适当提高EO浓度可以提高灭菌效率,但EO浓度与灭菌效率之间并不存在固定的比例关系。实验表明,EO浓度达到500mg/L后,再继续提高EO浓度一般需高于理想EO浓度,因为在实际EO灭菌过程中,还应考虑到EO的损失(如EO的水解、被灭菌物品对EO的吸附等)。
EO作用时间:EO作用时间使影响灭菌效果的关键因素,因为EO灭菌使气体灭菌,而气体灭菌并非快速灭菌,需要经历足够的时间才能达到灭菌效果。EO作用时间是灭菌验证时有待确定的关键灭菌参数之一,它与温度、湿度、EO浓度相关联,同时还受到被灭菌物品生物负载、包装材料、装载方式等多种因素的影响。
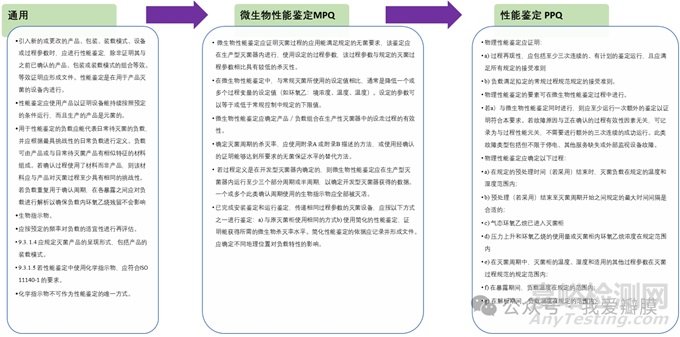
除了设备的IQ、OQ,PQ应该要考虑PPQ及MPQ
第五部分:环氧乙烷灭菌设计开发考虑因素
第一,产品包装应为透气包装,
•有利于EO、水蒸气、热量等穿透至灭菌部位
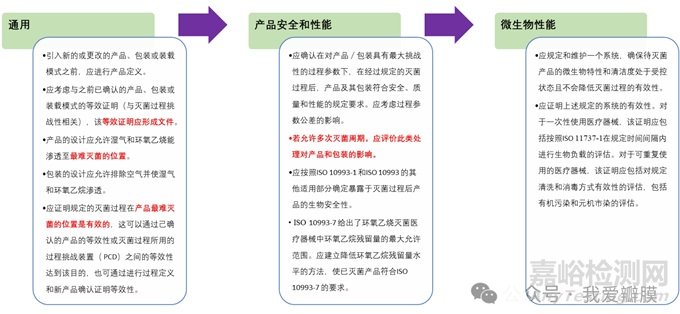
•有利于灭菌残留物(EO、ECH、EG)快速从产品中逸出 (残留限度见ISO 10993-7)
•有利于包装和产品完整,比如透气性不充分的包装有可能会在压力变化下爆裂开口
第二,产品的组成材料应能经受环氧乙烷灭菌,且不易吸附大量的灭菌残留物;(YY/T 1267-2015 为产品设计阶段的材料选择提供了依据;)
第三,产品的构造、折叠方式等应有利于气体流通,如果产品内部有闭合区,灭菌难度会大大增加;
第四,产品装载模式应有利于灭菌剂穿透,经确认的装载模式应予以规定,不能随意更改。
如果产品是堆放在托盘上,带着缠绕膜灭菌,则缠绕膜的形式也应经过确认,不得随意更改;
第五,产品的材料,生产包装工艺等应有利于将产品初始污染菌控制在较低的水平。
一般建议在产品设计和确认阶段,即考虑将来常规灭菌中偶尔失败,需要将产品重新灭菌的可能性。由于重复灭菌可能会带来更高的残留物水平、对产品性能和包装影响更大,为确认重复灭菌的可行性,通常将产品经过两次或多次全周期灭菌,然后监测产品性能、包装性能、灭菌残留物水平,确定允许的灭菌次数。
第五部分:环氧乙烷灭菌风险管理
第一,灭菌前的风险
EO聚集的风险
EO气体钢瓶连接的风险
混合气体使用的风险
灭菌前产品温度的风险
产品装载的风险
第二,预处理的风险
预处理室的风险:预处理室的设计合理性、温湿度传感器分布合理性
产品的风险:确认时确认预处理的最短处理时间,确保产品的温湿度
第三,灭菌周期的风险
灭菌周期的风险
真空度的风险
EO浓度的风险
气体暴露后抽真空的风险
解析室结构的风险:EO密度是空气的1.5倍,排放设施应采用下排风,如果是自然解析,则采用上侧被动送风,对面下侧主动排风模式,提高解析效果
第四,解析的风险
解析室结构的风险:EO密度是空气的1.5倍,排放设施应采用下排风,如果是自然解析,则采用上侧被动送风,对面下侧主动排风模式,提高解析效果
样品取样的风险:解析室中取样,样品应能够代表最差状态
产品脱EO放行风险:如自然解析应逐批次检测放行;如强制解析理论上可采用释放曲线放行。
第五,检测风险
BI无菌检测风险:BI无菌检测如不能立即进行,应放置冰箱进行冷藏,并对时间进行验证。
产品无菌检测的风险:不管产品在解析前做无菌检测还是解析后做无菌检测,均需提前进行无菌方法学确认,否则存在假阴性的风险。
产品性能检测的风险:依据产品技术要求设定出厂检测项目,样本量可以依据质量特性设定AQL抽样。
残留EO\ECH的风险:样品检测部位的选择应验证,残留曲线应确认
第六部分:环氧乙烷灭菌风险管理
•环氧乙烷(EO)灭菌产品的放行方式有两种:传统放行和参数放行。
1、传统放行是结合灭菌参数审核和BI检测结果进行产品放行的方式,这是目前国内采取的最主要方式,为各国监管机构所接受。
具体的做法是记录并保存每一个灭菌批的灭菌周期数据,并对这些数据进行审核,应完全符合经确认的灭菌过程规范,灭菌过程规范应按照GB18279.1/ISO 11135.1标准规定建立,并经过过程确认。同时还应按照确认的灭菌过程规范进行BI的无菌检测,BI应全部阴性,阳性对照应阳性。上述要求,全部满足可以判定产品无菌。 环氧乙烷灭菌的工艺参数非常之多,当出现轻微、不影响灭菌效果工艺偏差时,BI检测结果能为是否放行产品提供微生物学依据。
•传统放行的缺点是BI培养需要7天,可能会延长产品周转时间,另外BI本身及其检测也需要一定的成本或者产生部分费用。
在灭菌确认方面,ISO11135-1:2014规定要定期进行再确认,但对于“定期”的频率并未做硬性规定,ISO/TS 11135-2:2008 建议至少每两年进行一次再确认。
2、参数放行是一种不使用生物指示剂来放行经灭菌的无菌产品的方法,而依靠证明物理处理参数均符合所有的规范来放行无菌产品,在上述传统放行灭菌周期数据的基础上增加如下的三项参数记录要求:
•在整个灭菌周期,至少从2个位置记录灭菌温度数据,
•在处理阶段(加湿和保湿),直接测定柜内的湿度
•按照规定的时间间隔,通过直接分析灭菌柜内的气体确定环氧乙烷浓度
参数放行对灭菌设备提出了更高的要求,与一般设备相比,还需要灭菌柜中有两个在不同位点安装的温度传感器,有能直接读取相对湿度的传感器,有能直接读取环氧乙烷浓度的传感器。
参数放行由于免除了BI检测,具有产品周转快、放行成本低等优势。但是由于缺乏BI检测结果这一块微生物学支持,当出现灭菌工艺偏差时,灭菌批被拒收的概率随之加大。如果是不能重复灭菌的产品,其质量风险非常高,所以通常采用参数放行的产品,至少能经受两次环氧乙烷灭菌而不影响产品性能或包装,且重复灭菌后的残留水平也能符合限度标准。
在灭菌确认方面,ISO11135-1:2007规定参数放行的再确认必须每年进行一次。另外需要特别指出的是,中国的医疗器械监管机构还未接受参数放行。
第七部分:环氧乙烷灭菌监管要求
医疗器械灭菌是特殊过程,是监管部门重点关注的内容,以下是根据医疗器械生产质量管理规范(GMP)检查员多年检查情况,总结出来的监管要点。
人员:灭菌控制相关岗位操作人员和检查人员是否经过专业技术培训,是否具备实际操作技能。
设施:灭菌车间是否设置在专用房间内,是否有相应的安全、通风和排毒设施;EO存储区域是否独立和通风;解析是否在独立的柜室或房间内进行。
设计开发:是否进行了灭菌确认,包括安装确认(IO)、运行确认(OQ)和性能确认(PQ);是否对再确认启动的条件和周期进行了文件规定;灭菌确认报告中是否规定了灭菌参数和无菌保证水平、灭菌产品的呈现形式、产品的装载模式、解析的条件、产品的初始污染菌和微粒污染的可接受水平;微生物性能验证中是否对生物指示剂枯草芽孢放置分布进行了规定。
文件控制:是否制定批号管理文件,并对生产批号和灭菌批号的组批方式进行规定。
生产管理:灭菌记录中是否完整记载每批产品的灭菌参数(灭菌温度、相对湿度、EO浓度等)、有关设备编号、灭菌日期、操作人员与复核人员签名。
质量控制:是否明确EO灭菌残留量的控制水平及检验方法,是否具备EO残留量的检验能力并按规定进行检验;灭菌设备上的计量器具、灭菌前后用到的检验设备是否按规定进行了定期校验并处于有效期内。 以上基本覆盖了政府监管人员最常关注的现场检查切入点,通过这些切入点,监管人员可以更高效地发现灭菌控制环节的主要问题,并通过一系列溯源实现对整个生产质量管理体系的全面监督检查。

来源:我爱瓣膜


