您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2024-09-25 08:27
一、 写在前面
Western Blotting(WB)作为常见的蛋白检测手段之一,通常是绝大部分科研工作者不可避免的一项基础实验。然而,其实验流程相对较为复杂,忽视任一细节均有可能导致整个实验的失败,这也常令很多科研者苦不堪言。目的条带不清晰而背景却又黑又脏,甚至显影出来只能看见黑乎乎的背景,这是WB中最为常见的问题之一,是什么原因导致了高背景的出现?面对这种情况我们该如何解决呢?本文就从以下几个方面进行详细地介绍。

二、 常见的背景来源及解决方案
1.样品质量
样品质量是决定WB成败的关键一步,绝大多数情况下我们均是以提取总蛋白作为WB的开端。而在总蛋白提取过程中不可避免会受到诸如核酸、脂类、裂解液等物质的干扰,样品纯度受到影响自然而然会带来高背景。此外,在我们目的蛋白表达量较低的情况下,其在总蛋白中的比例也相应较低,不易检测到,为优化目的条带,不得不做出提高抗体浓度、加大上样量等措施,由此造成高背景。
因此,在提取总蛋白时,一方面我们需要保证尽可能地提高样品纯度,如:吸取蛋白时需小心谨慎,避免吸入杂质;另一方面则要防止蛋白降解造成蛋白丢失,如:提取过程均在低温环境中进行、加入蛋白酶抑制剂防止蛋白降解等。
2.上样量
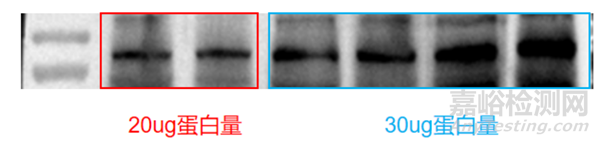
上样量对背景也有影响。如果预实验发现蛋白浓度较低,那么下次提取时就需要适当提高组织或细胞用量,而不可一味地加大上样量,如下图所示,加大上样量时,背景也会随之加深。
3.封闭
封闭的目的在于去除其他无关蛋白的影响,倘若封闭不完全,就会产生高背景。这通常也是产生高背景时需要优先考虑并进行优化的因素,一方面可以提高封闭液的浓度,另一方面亦可延长封闭时间,以降低背景。
4.洗涤
洗涤不彻底也会导致一些非特异性结合的残留,从而产生高背景。因此,可以通过加大洗涤液的用量、增加洗涤次数、延长洗涤时间来改善。
5.膜
一方面,需要确保我们所采用的NC膜或PVDF膜保存得当,是干净无污的,以免膜本身的原因影响显影造成高背景;另一方面,在整个操作过程中要充分确保膜的湿润,谨防干膜带来高背景。
6.抗体
抗体浓度过高时也会导致高背景,甚至条带反白,因此,需通过预实验摸索抗体浓度及孵育时间,寻求合适的抗体孵育条件。另外,抗体本身的质量也是造成高背景的关键,抗体质量有问题,要么直接无条带,要么产生过多杂带造成高背景,此时就需要考虑换抗体,当然,由于抗体售后过于繁琐,更换抗体也会增加实验成本,耽误实验进度等问题,因此,更换抗体也是我们毫无束手之策时才需要考虑的。

三、 其他实用小Tips
1.洗涤时,无论采用PBST还是TBST,Tween-20均在其中发挥着关键作用,其能有效去除非特异性结合产物,降低背景,可以将其通俗的理解为去污剂,倘若背景较深时,可以适当加大PBST或TBST中Tween-20的用量,以有效去除背景;
2.显影后倘若发现背景较深,可再次进行封闭然后重新孵育抗体;
3.背景较深时,亦可将条带置于洗涤液中放在4℃冰箱保存过夜,浸泡一晚甚至更长时间后再去显影,可以有效降低背景,但需以不影响目的带为宜。

来源:实验老司机


