您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2024-10-31 17:49
医疗器械的清洗过程确认是确保器械安全、有效的关键环节,也是官方机构监管核查的重点内容之一。上月,北京市药品监督管理局发布了《北京市医疗器械产品清洗过程确认检查指南(2024版)》(征求意见稿),不仅为监管人员提供了清晰的检查指导,也为医疗器械生产企业开展产品清洗过程确认提供了重要的参考依据,并且再次强调了医疗器械清洗过程确认的重要性。
器械污染来源及清洗过程确认的重要性:
医疗器械产品由于生产环境、生产过程、原材料和人员等原因,往往不可避免地带有一些污染物。这些污染物影响组件后续的生产或者成品的安全,需要对产品进行过程清洗或者末端清洗。对于使用前需要灭菌或消毒的产品,清洗就是使用适宜的溶剂,按照一定的程序除去产品上的污染物,减少产品灭菌前的初始污染,以保证产品最终灭菌或消毒效果。产品清洗过程确认就是通过适宜的方法采集足够的数据,以证明按规定方法清洗后的产品,能始终如一地达到预定的清洗效果。
同时,清洗过程确认也是企业质量控制体系的重要组成部分。通过对清洗过程的确认,企业可以评估和改进清洗工艺,确保清洗效果始终达到预期效果。这不仅有助于提升产品的品质,还可以降低生产成本,提高企业的竞争力。
清洗过程确认指南检查要点
指南详细规定了医疗器械清洗过程确认的检查要点和流程,包括清洗方法的选择、清洗参数的设定、清洗效果的验证等。这些规定不仅有助于企业优化清洗工艺,提高清洗效率,还能确保清洗后的医疗器械达到预期的清洁度要求,为后续的灭菌和消毒过程奠定坚实基础。此次修订,对原指南中已作废或更新的法规和标准进行更新或增加,如将《医疗器械的灭菌微生物学方法第1部分:产品上微生物总数的估计》(GB/T19973.1-2005/ISO 11737-1:1995)更新为《医疗保健产品灭菌微生物学方法第1部分:产品上微生物总数的确定》(GB/T 19973.1-2023),将《一次性使用麻醉用过滤器》(YY 0321.3-2009)更新为《一次性使用麻醉用过滤器》(YY 0321.3-2022),将《药品生产验证指南》(2010)更新为《药品生产验证指南》(2023),新增《医用输液、输血、注射器具微粒污染检验方法》(YY/T 1556-2017)。
同时,结合近年来医疗器械生产监管人员在对医疗器械产品清洗过程确认的监督检查过程中的实践经验进行梳理和分析,并在指南中进行了完善。如对清洗过程确认的再确认情况进行了补充,并明确了回顾性验证的条件;对清洗方法的选择还应考虑生产工艺和生产环境的影响,并对使用自动化设备清洗应具备的条件进行了合并表述等。
清洗过程确认指南检查要点
ISO 19227标准,自2018年3月26日正式发布以来,便成为了骨科植入物行业内产品洁净度的明确依据。
清洗确认的核心要求:
清洁程度:
ISO 19227标准规定了植入物表面和内部必须达到的清洁程度,强调去除所有有机物质、细菌和可能对人体有害的化学物质的重要性。这意味着,骨科植入物在交付给医生之前,必须经过适当的清洁和灭菌过程,以确保它们不含细菌、病毒或其他有害物质。
清洗方法:
标准规定了用于清洁植入物的各种方法,包括手工和机械清洁方法,以及使用特定的清洁剂或消毒剂。这些方法必须符合相关的卫生和安全标准。
风险管理:
在清洗过程的设计、确认和持续使用过程中,制造商应采用风险管理的方法,识别关键过程清洗和最终清洗中的潜在危害,并制定相应的解决方案。
清洗族:
产品可以根据相同的清洗工艺、类似的清洗难度、同样的接受水平分为不同的清洗家族。每个清洗家族由相同的最差样品作为代表,以简化确认和持续过程验证的活动。
清洁效果评估:
清洗后,应进行微生物学和化学测试,以及视觉检查,以确保达到了规定的清洁程度。这些测试方法需要确认和记录,包括根据产品上污染物类型所选择的测试方法的理由、浸提效率、检测限度、定量限度和方法的准确性等。
记录和报告:
所有与植入物清洁过程相关的信息,包括使用的清洁方法、评估结果等,都应详细记录,并在必要时向相关方报告。
另外关于清洗确认的要求和测试项目的选择还可以参考如下标准:
ASTM F3127-2022 医疗器械生产中清洗过程的确认
ASTM F2847-2017 植入物和一次性灭菌器械上残留的评估
ASTM F2459-2018 重量法测试金属器械组件的残留
具体测试项目与测试方法总结如下:
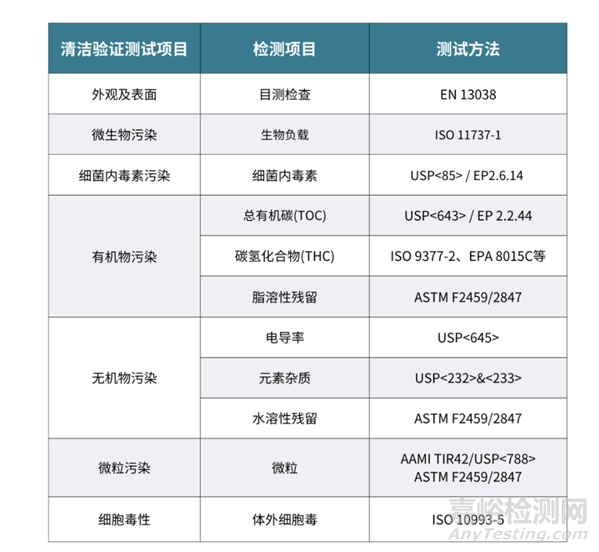

来源:Internet


