您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2024-11-08 08:16
《药品微生物实验室质量管理指导原则》旨在规范药品微生物检验实验室的质量控制。本次修订涉及微生物测量不确定度、培养基、方法验证等方面,本文将介绍这些修订内容及其应对策略。
1、 微生物测定不确定度
变化一
微生物限度计数法属于定量检测,因此涉及测量不确定度的问题。当前存在以下几个问题:
① 目前还没有针对药品测量不确定度的明确指导原则。此前曾有草案出台,但由于争议较大,最终未能落实。
② 药品检测方法通常经过验证,其合格范围较宽(50%-200%)。在此基础上引入测量不确定度,个人认为意义不大。
变化二
实际操作中,定期校准移液枪和天平,并加强人员对移液枪的正确使用培训,更具实用性。
2、 培养基
变化一
本次修订删除了“平板培养基存放时间一般不超过一周”的规定,要求每个企业自行进行有效期验证。
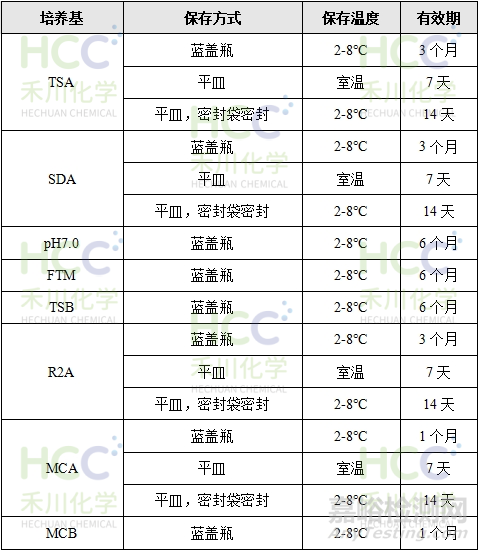
变化二
在进行培养基有效期验证时,需注意某些控制菌培养基含有不稳定成分,因此有效期不宜设定过长。以下为参考有效期:
变化三
每批培养基都需要进行适用性检查,无菌检查中已有说明,不再赘述。
变化四
方法确认和替代验证应遵循《药品微生物分析方法验证、确认及转移指导原则》。但目前该文件内容较为简略,可操作性不强,建议参考PDA TR57《生物技术产品的分析方法验证与转移》一文,内容详实且更为具体。
3、 菌种
菌种这块内容没有变化,但是比较遗憾的是这次还是没有明确写出承认那些菌种保藏机构的名称和具体菌种编号,这样在企业进行中美申报时候,给申报工作带来了一定的不确定性。特别是黑曲霉菌,目前从基因测序角度来看,黑曲霉和巴西曲霉还是不一样的,建议中美双报的方法验证时,这两个菌都做一下。

来源:禾川化学官微


