您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-12-02 09:45
在肿瘤治疗领域,抗体偶联药物(ADC)以其靶向递送和高效杀伤肿瘤细胞的能力,成为新一代的抗癌明星。随着ADC药物的广泛临床研究及应用,眼毒性这一不良反应也引起了广泛关注。据报道[3,6]大多数眼部不良反应程度轻微且可逆,仍有部分患者受不良反应导致影响治疗进程。常见报道的导致用药中断、减少或终止的案例主要有周围神经病变、结膜不良反应和角膜不良反应等。此外,目前已有3个ADC药物(Belantamab Mafodotin (Blenrep®),Tisotumab Vedotin (Tivdak®),Mirvetuximab Soravtansine (Elahere ®))因其眼毒性被FDA要求在说明书中添加黑框警告[7]。本文基于现有文献报道的数据[1-3,6],总结了关于ADC药物眼毒性的产生机制,以研究如何在临床前实验中尽早发现眼毒性,降低候选化合物的毒性风险。
抗体偶联药物(ADCs)的眼毒性主要发生机制
1. 非特异性摄取(Non-Specific Uptake)
ADCs可能通过非特异性内吞作用(如巨胞饮作用)被眼部细胞摄取,导致药物在眼部积聚,从而引起毒性。例如,Zhao[2]等人的研究表明,通过调节巨胞饮作用可以减少ADCs的眼毒性。如图1中绿框所示。
2. 游离毒素释放和扩散
ADCs在体内的稳定性和游离药物释放特性可能导致眼毒性。如果连接子的稳定性不足,可能导致游离药物在血液循环中过早释放,增加了非靶向组织(如眼睛)的暴露。如图1中红框所示。
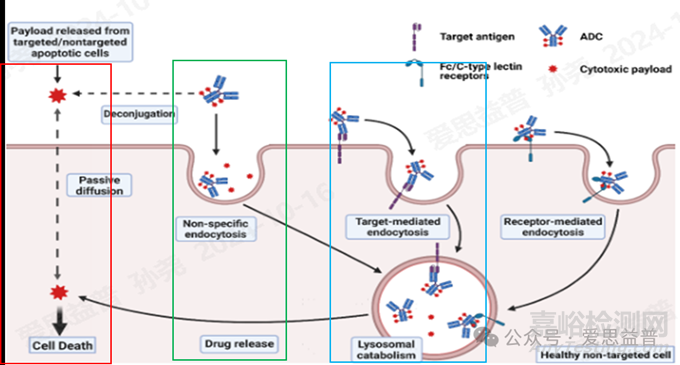
图1. ADC毒性机制示意图[3]
3. 抗原表达
正常组织中靶点抗原表达水平较低,ADCs仍可能通过靶向结合表达该抗原的健康细胞或者组织引起毒性。例如,Tisotumab Vedotin(维替索妥单抗)的眼毒性,因组织因子(Tissue factor,TF) 在结膜中有表达[6],体现出来的眼毒性被认为是靶点介导的(on-target,off-tumor)毒性。
因眼组织中的靶点高表达,会导致眼睛对该类ADCs的在靶毒性更敏感。例如,EGFR在角膜基底上皮细胞中表达,这可能与有些靶向EGFR的药物的眼毒性有关[6]。如图1中蓝框所示。
ADCs的药物分布和代谢情况可能导致眼毒性,如药物或其代谢物在眼睛中分布高,药物可能在眼组织发生积累。
4. 旁观者效应 (Bystander Effect)
某些ADCs的有效载荷(如MMAE)在被释放后可以分布到周围组织或者进入体循环,加上在眼周围血管丰富,这种旁观者效应有可能导致眼毒性。
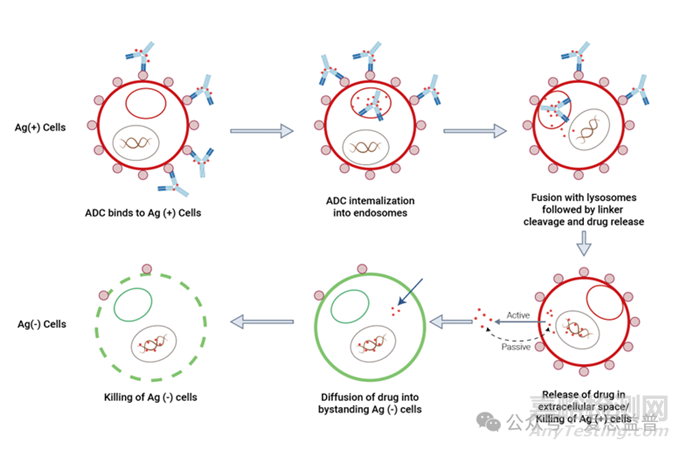
图2. 旁观者效应示意图
5. 物理化学特性
ADCs的物理化学特性,如所带的电荷情况和疏水性,可能影响其在眼组织中的分布和游离毒素的释放。例如,带正电荷的ADCs可能通过电荷介导的内吞作用被眼周的细胞摄取,而带来毒性。
ADC药物产生眼毒性的实例
1.现有文献存在眼毒性的ADC药物及其可能的原因分析
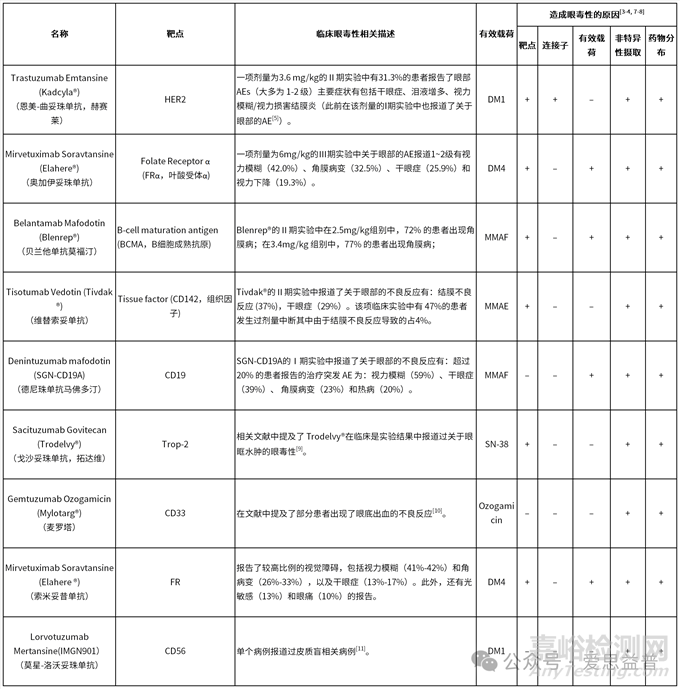
表1. 存在眼毒性的ADC药物及其可能的原因分析
2. 从有效载荷角度分析ADC产生眼毒性的原因

表2. 可能会引起ADC眼毒性的有效载荷与其潜在机制
3. 从靶点分布角度分析ADC产生眼毒性的原因
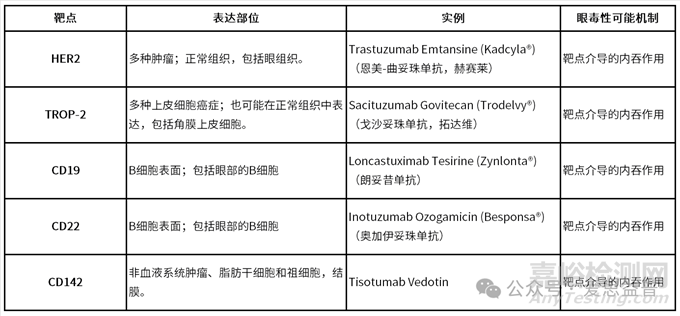
表3. 可能引起ADC眼毒性的靶点及其作用机制

表4. Trop2在人和小鼠正常和肿瘤组织的蛋白表达
以TROP-2靶点为例,表4汇总了Trop2在人和小鼠正常和肿瘤组织的蛋白表达情况[12]。此外,Lara等的研究发现,Trop2在啮齿类动物和食蟹猴角膜上皮高度表达,并且这一现象与人类Trop2突变后导致的凝胶状滴状角膜营养不良(GDLD)的机制一致[13]。Trop2在角膜上皮的高度表达表明,以Trop2为靶点的制剂在全身给药时,需要特别关注其潜在的眼毒性。
4. 从连接子性质角度分析ADC产生眼毒性的原因

表5. 可能会引起ADC眼毒性的连接子与其潜在机制
临床前研究抗体偶联药物眼毒性的手段
在临床前阶段,建议通过体外以及体内相关实验,结合ADC的药代动力学和毒理学进行综合评估。以下是一些关键的步骤和考虑因素:
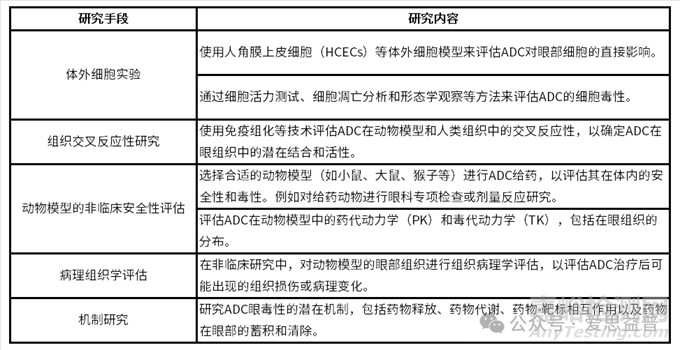
除了上述实验内容我们也可将研究中的候选ADC分析与已上市或者已有临床数据的ADC性质进行比较,特别是那些已知有眼毒性的ADC,以评估候选分子潜在眼毒性风险。
爱思益普拥有ADC生物学及DMPK一体化筛选评价平台,支持包括新的细胞毒payload(如拓扑异构酶抑制剂、PARP抑制剂、ATR抑制剂等)或新作用机制Payload(如靶向蛋白降解剂、免疫激动剂等)及linker-payload的筛选,抗体及ADC体外筛选评价、体内药理药效评价,ADC DMPK(如全面稳定性评价、释放机制研究、生物分析方法开发等)等一体化筛选评价服务。通过这些综合性服务,爱思益普能够为ADC药物的研发提供全面的支持,加速新药的发现和开发过程。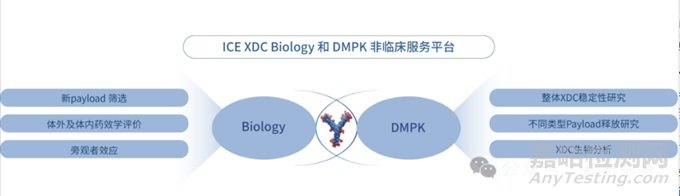
参考文献
[1] Jackson D, Stover D. Using the Lessons Learned from the Clinic to Improve the Preclinical Development of Antibody Drug Conjugates. Pharm Res. 2015 Nov;32(11):3458-69.
[2] Fisher JE Jr. Considerations for the Nonclinical Safety Evaluation of Antibody-Drug Conjugates. Antibodies (Basel). 2021 Apr 19;10(2):15.
[3] Nguyen TD, Bordeau BM, Balthasar JP. Mechanisms of ADC Toxicity and Strategies to Increase ADC Tolerability. Cancers (Basel). 2023 Jan 24;15(3):713.
[4] Donaghy H. Effects of antibody, drug and linker on the preclinical and clinical toxicities of antibody-drug conjugates. MAbs. 2016 May-Jun;8(4):659-71.
[5] Krop IE, Beeram M, Modi S, Jones SF, Holden SN, Yu W, Girish S, Tibbitts J, Yi JH, Sliwkowski MX, Jacobson F, Lutzker SG, Burris HA. Phase I study of trastuzumab-DM1, an HER2 antibody-drug conjugate, given every 3 weeks to patients with HER2-positive metastatic breast cancer. J Clin Oncol. 2010 Jun 1;28(16):2698-704.
[6] Eaton JS, Miller PE, Mannis MJ, Murphy CJ. Ocular Adverse Events Associated with Antibody-Drug Conjugates in Human Clinical Trials. J Ocul Pharmacol Ther. 2015 Dec;31(10):589-604.
[7] Raheem F, Alsuhebany N, Hickey Zacholski E, Paulic N, Sandler A, Uk N, Moore DC. Ocular toxicities associated with antibody drug conjugates and immunotherapy in oncology: clinical presentation, pathogenesis, and management strategies. Expert Opin Drug Saf. 2023 Jul-Dec;22(10):921-928.
[8] Dy GK, Farooq AV, Kang JJ. Ocular adverse events associated with antibody-drug conjugates for cancer: evidence and management strategies. Oncologist. 2024 Jul 24:oyae177.
[9] Gui X, Zhao J, Ding L, Chai J, Lai H, Cai Y, Luo S, Zeng Y, Wu W, Chen H, Yao H, Wang Y. Assessing real-world safety concerns of Sacituzumab govitecan: a disproportionality analysis using spontaneous reports in the FDA adverse event reporting system. Front Oncol. 2023 Oct 6;13:1276976.
[10] Piccaluga PP, Martinelli G, Rondoni M, Malagola M, Gaitani S, Visani G, Baccarani M. First experience with gemtuzumab ozogamicin plus cytarabine as continuous infusion for elderly acute myeloid leukaemia patients. Leuk Res. 2004 Sep;28(9):987-90.
[11] Wilson, C., Leaning, D., Shankland, K., et al. Cortical blindness as an unusual adverse drug reaction. J. Med.Cases. 1:47–50, 2010.
[12] Stepan LP, Trueblood ES, Hale K, Babcook J, Borges L, Sutherland CL. Expression of Trop2 cell surface glycoprotein in normal and tumor tissues: potential implications as a cancer therapeutic target. J Histochem Cytochem. 2011;59(7):701-710.
[13] Tsujikawa M, Kurahashi H, Tanaka T, et al. Identification of the gene responsible for gelatinous drop-like corneal dystrophy. Nat Genet. 1999;21(4):420-423.
[14] Zhao, H.; Atkinson, J.; Gulesserian, S.; Zeng, Z.; Nater, J.; Ou, J.; Yang, P.; Morrison, K.; Coleman, J.; Malik, F.; et al. Modulation of Macropinocytosis-Mediated Internalization Decreases Ocular Toxicity of Antibody-Drug Conjugates. Cancer Res. 2018, 78, 2115–2126.
[15] Matulonis UA, Birrer MJ, O'Malley DM, et al. Evaluation of Prophylactic Corticosteroid Eye Drop Use in the Management of Corneal Abnormalities Induced by the Antibody-Drug Conjugate Mirvetuximab Soravtansine. Clin Cancer Res. 2019;25(6):1727-1736.

来源:爱思益普


