您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2025-02-28 17:57
EMA近日发布了一份针对高风险医疗器械的指南,详细说明了如何向专家小组申请临床调查和/或临床开发策略的建议。该指南旨在帮助制造商更好地理解申请流程,确保其产品符合欧盟医疗器械法规(MDR)的要求。此指南的发布对高风险医疗器械制造商们是个值得关注的好消息,下面让我们看一下具体的咨询流程。
背景信息
根据MDR Article 61(2),医疗器械专家小组可以为III类器械和IIb类有源器械(用于给药和/或从人体移除药物)的制造商提供临床开发策略和临床调查建议。该法规旨在确保高风险医疗器械的安全性和有效性。
自2023年2月27日起,EMA启动了一个为期三阶段的试点项目,并于2024年6月30日结束。试点项目成功后,EMA现已全面实施科学建议计划。制造商或其授权代表可以申请专家小组的建议,但申请必须满足以下条件:
器械为III类或用于给药和/或从人体移除药物的IIb类有源器械;
问题仅涉及临床方面;
临床调查问题仅涉及尚未开始的调查(上市前或上市后)。
此外,当申请超过专家小组处理能力时,有两类产品会考虑优先排序进行审核,这两类产品为:用于满足未满足的医疗需求的器械,和可能对临床或健康产生重大影响的新器械。
值得制造商们注意的是,2025年度专家小组提供科学建议是不收取费用的,制造商可以抓紧此机会向专家小组获取建议。
临床咨询申请步骤
1.意向书:制造商需先注册ServiceNow账户,通过EMA的ServiceNow平台先提交意向书,表达申请意愿。EMA将通过电子邮件的形式告知已确认收到申请,并安排一次解释性会议。
2.探索性会议:制造商需向EMA简要介绍其器械的基本信息、监管状态和拟提出的问题,EMA将介绍程序并回答相关程序问题。
3.提交草案简报文件:制造商需根据EMA网站上的模板准备并提交草案简报文件。EMA将确认收到文件并安排预提交会议,EMA也可将反馈以书面形式提供。
4.预提交会议:制造商需准备简报,介绍其器械和提出的问题。会议将讨论制造商的问题,并提供对简报文件的反馈,反馈意见也将会以书面形式提供给制造商。
5.最终简报文件提交(D1):制造商需根据预提交会议的反馈修改并提交最终简报文件。EMA将验证收到的最终申请并转发给专家小组,并通过邮件形式通知制造商程序开始日期以及会议时间。
6.专家小组问题清单:问题清单将在“提交时间表中”(详见下图)规定的时间内提供给制造商,清单中包括专家小组对制造商提出的任何问题的澄清。
7.讨论会议及书面答复:制造商需准备会议演示文稿,对提出的问题做出答复,并在会议开始前发给专家小组,在会议后两天内制造商需要根据会议讨论的情况,对问题清单中的内容做出书面答复。(注:如果专家小组没有给出问题,则步骤6、7取消)
8.专家小组提供建议(D60):专家小组将在规定时间内提供建议,并通过ServiceNow平台上传建议,并通过邮件通知制造商。
后续步骤
EMA将每年发布专家小组提供的建议的汇总信息,但具体建议内容不会公开。制造商应充分考虑专家小组的意见,并将考虑因素记录在临床评估报告中由公告机构进行符合性评估时予以评估。EMA鼓励制造商积极参与这一程序,以确保其高风险医疗器械的临床开发策略和调查计划符合最新的法规要求。
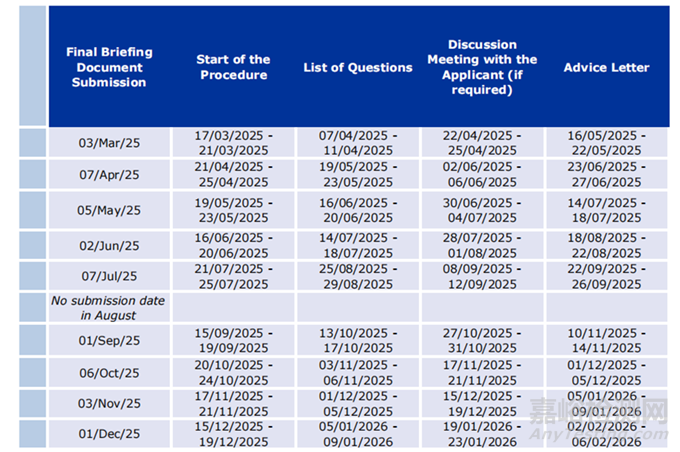
最终简报文件提交时间表
虽然制造商可以随时提交意向书,但只能根据下面提供的2025年时间表提交所需的最终简报文件:
小TIPS:EMA简介
欧洲药品管理局(EMA)是欧盟下属的专门机构,负责药品和医疗器械的科学评估、监督和安全监测。对于某些高风险医疗器械,EMA提供技术和科学支持,协助专家小组进行评估。在某些情况下,公告机构在颁发CE证书之前必须征求EMA的科学意见。
EMA的职责包括:
1. 药械组合产品的评估:
EMA负责评估与医疗器械组合使用的药品的安全性和有效性。
2. 提供含有辅助药物医疗器械的科学意见:
对于含有辅助药物的医疗器械,公告机构必须征求EMA关于该物质质量、安全性和有效性的科学意见,特别是当该物质来源于人类血液或血浆、或已被EMA评估过。
3. 伴随诊断器械的科学意见:
如果药品属于集中审批程序的范围,公告机构就伴随诊断试剂与药品的适用性向EMA征求科学意见。
4. 含可吸收物质的医疗器械的科学意见:
对于含可吸收物质的医疗器械,公告机构必须征求EMA关于该物质是否符合 Directive 2001/83/EC附件I要求的科学意见。
5. 高风险医疗器械的支持:
EMA 支持医疗器械专家小组,为公告机构就某些高风险医疗器械和体外诊断器械提供科学评估意见。

来源:海河生物视界


