您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-03-05 20:35
前言
强制降解试验和影响因素试验
在网上会看到一种说法,影响因素试验是中国药典特色,中国特有描述说法;国际通用做法是强制降解试验,结论影响因素试验是中国申报必须做的,国外仅做强制降解试验。后来看到一个原研药,FDA\欧盟\中国均已经批准,该品种由于湿度会对药品有影响,在美国上市产品中在原包装外又加了一层铝塑袋包装,在欧盟和中国上市产品中未有铝塑袋。根据中国药典进行了影响因素试验,从试验结果可知湿度会对药品影响。从科学研究角度去考虑,影响因素试验结果可以判断什么条件会对药品影响,对工艺或贮藏可以提供依据。经过这个实际案例,当时觉得中国申报要进行影响因素试验还是科学的。
经过查询中美欧ICH法规,上述理解太偏颇了,难道国际通用做法真的只是进行强制降解试验吗?其实不是,只是英文翻译导致了某些理解偏差,其实各国监管理念是一致的,都是从科学角度去设计试验,阐明哪些条件会影响药品,给处方工艺或贮藏等指导。
个人思考
强制降解试验和影响因素异同
强制降解试验:英文用Forced degradaton testing更合适,
试验目的:了解杂质降解途径和降解产物,为原料工艺、制剂处方开发提供依据,开发稳定性指示功能的分析方法,分析方法验证专属性试验中的一部分;这块内容主要在分析方法验证中
影响因素试验:英文用Stress testing
试验目的:探讨药物固有稳定性、了解影响其稳定性因素及可能的降解途径与降解产物,为制剂生产工艺、包装、贮存条件和建立降解产物分析方法提供科学依据;这块内容主要在稳定性试验中
试验条件:英文有Stress conditions
国内和国外申报都需要进行强制降解试验(Forced degradaton testing)和影响因素试验(Stress testing)
相同点:试验条件都有光照、高温、湿度水解;所以容易搞混
不同点:强制降解试验是需要破坏出一定量的杂质,以说明分析方法的专属性;
影响因素试验是为了说明药物固有稳定性,对光等是否敏感,如敏感,对包装有什么要求;对热敏感,工艺上该如何优化,保存条件该怎么定;影响因素试验不强调要破坏出降解产物
强制降解(破坏)试验
定义和目的
《中国药典2020年版四部9101分析方法验证指导原则》-专属性:也可用强光照射、高温、髙湿、酸(碱)
水解或氧化的方法进行强制破坏, 以研究可能的降解产物和降解途径对含量测定和杂质测定的影响。
《国家药品标准工作手册》(第四版):国家药品标准(化学药品)有关物质检查指导细则p60-方法验证-专属性:破坏性试验适合于考察降解产物,更适合于制剂有关物质检查方法的验证。
CDE文献《强制降解试验在药物研发中的应用 Application of Forced Degradation Testing in Drug development》2020年
强制降解试验也称为破坏性试验,主要目的:
解析降解产物,确定药物的降解途径和机制;
为药物安全性提供支持;
有助于代谢产物研究;
有助于原料工艺、制剂处方和工艺的开发
开发具有稳定性指示能力的分析方法
指导药物包装系统开发,提示药物敏感性
CDE文献《杂质检查分析方法建立过程中破坏性试验的意义和存在的问题分析 Effects of stressing test for determination of impurities during validation of the analytical procedure》2008年
破坏性试验,也称强制降解试验(stressing test):在人为设定的特殊条件下,如酸、碱、氧化、高温、光照等,引起药物的降解,通过对降解产物的测定,验证检测方法的可行性,分析药物可能的降解途径和降解机制。
ICH Q2(R2)Validation of Analytical Procedures 2023
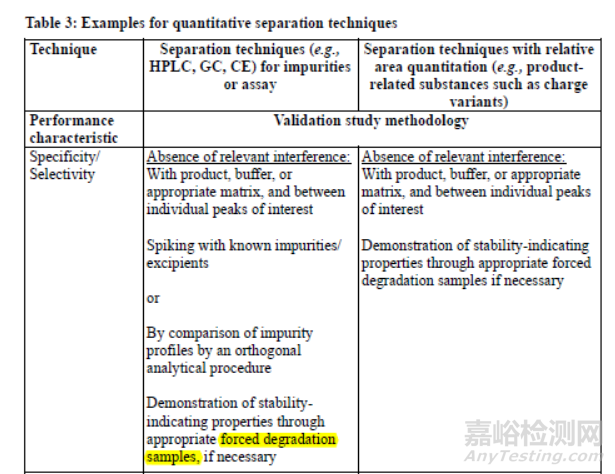
ICH Q1B Stability Testing Photostability Testing of New Drug Substances and Products

强制降解试验目的:评价原料药的总体光敏感性,用于方法开发及降解途径的阐明。试验样品可能包括原料药和/或原料药的简单溶液/混悬液,用于进行分析方法验证。
ICH Q3B Impurities in New Drug Products

分析方法验证-专属性:在强制条件下-光,热,湿度,酸/碱水解和氧化条件下证明能检测特定和非特定降解产物
ICH M4Q(R1) Module3:Quality

3.2.S.7.1 稳定性结果总结包括强制降解研究和强力试验(stress conditions 可理解为国内影响因素试验)
FDA文献:FDA Perspectives: Scientific Considerations of Forced Degradation Studies in ANDA Submissions

强制降解试验类似于Stress testing和purposeful degradation(即在Stress testing的基础上要有目的进行降解);在分析方法开发和质量标准设定,QbD处方开发设计有重要作用。
综上-个人思考
强制降解试验:英文用Forced degradaton testing更合适,
试验目的:了解杂质降解途径和降解产物,为原料工艺、制剂处方开发提供依据,开发稳定性指示功能的分析方法,分析方法验证专属性试验中的一部分
影响因素试验
定义和目的
中国药典2020年版四部《9001原料药物与制剂稳定性试验指导原则》

20150205 《化学药物(原料药和制剂)稳定性研究技术指导原则》
稳定性试验通常包括影响因素试验、加速试验和长期试验等。影响因素试验主要是考察原料药和制剂对光、湿、热、酸、碱、氧化等的稳定性,了解其对光、湿、热、酸、碱、氧化等的敏感性,主要的降解途径及降解产物,并据此为进一步验证所用分析方法的专属性、确定加速试验的放置条件及选择合适的包装材料提供参考。
影响因素试验通常只需1个批次的样品,试验条件应考虑原料药本身的物理化学稳定性。高温试验一般高于加速试验温度10℃以上(如50℃、60℃等),高湿试验通常采用相对湿度75%或更高(如92.5% RH等),光照试验的总照度不低于1.2×106Lux·hr、近紫外能量不低于200w·hr/m2。另外,还应评估原料药在溶液或混悬液状态、在较宽pH值范围内对水的敏感度(水解)。如试验结果不能明确该原料药对光、湿、热等的敏感性,则应加试2个批次样品进行相应条件的降解试验。
国家食品药品监督管理总局关于发布生物制品稳定性研究技术指导原则的通告(2015年第10号)《生物制品稳定性研究技术指导原则》
强制条件试验:影响较为剧烈的条件下进行的稳定性研究,如高温、光照、振动、反复冻融、氧化等。
中国药典2020年版四部《9402生物制品稳定性试验指导原则》

ICH Q1A(R2)Stability Testing of New Drug Substances and Procedures

Stress testing对应国内的影响因素试验(ICH Q1A中文翻译是强力试验),比加速试验剧烈的条件下,了解降解产物,降解途径,揭示药物固有稳定性

ICH Q5C
QUALITY OF BIOTECHNOLOGICAL PRODUCTS:
STABILITY TESTING OF BIOTECHNOLOGICAL/BIOLOGICAL PRODUCTS

Studies under stress conditions有助于揭示在偏离拟定贮藏的条件下对产品的影响,哪些特定检测指标是产品稳定性指示的关键指标,揭示降解途径
EMA Guideline on Stability Testing: Stability testing of existing active substances and related finished products

Stress testing有助理了解降解途径,药物固有稳定性,验证已使用分析方法的稳定性指示功能,比加速条件剧烈的温度条件、湿度、光、氧化等。
综上-个人思考
影响因素试验:对应国外的Stress testing,
试验目的:了解杂质降解途径和降解产物,探讨药物的固有稳定性,了解影响其稳定性的因素,为制剂生产工艺、包装、贮存和建立降解产物分析方法提供科学依据,是稳定性试验中的一部分。
参考资料
中国药典2020年版四部9001和9101
ICH Q1/Q3/Q5
指导原则:化学药物(原料药和制剂)稳定性研究技术指导原则、生物制品稳定性研究技术指导原则
CDE文献:强制降解试验在药物研发中的应用
FDA文献:FDA Perspectives Scientific Considerations of Forced Degradation Studies in ANDA Submissions
EMA:guideline-stability-testing-stability-testing-existing-active-substances-and-related-finished-products_en

来源:Supin散记


