您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-04-07 15:22
心脏起搏器是治疗心律失常的常见医疗设备,传统的临时起搏器通常通过侵入性手术进行植入,这不仅会带来较大的创伤风险,还可能导致异物排斥和长期依赖电池等问题,尤其对于儿童和不适合血管植入的病人来说,传统方法存在一定的局限性。因此,如何开发一种微创、可降解、无线控制的临时心脏起搏器,成为了心脏病治疗领域亟待解决的难题。
针对这一挑战,John A. Rogers教授、Igor R. Efimov教授、Rishi Arora教授、黄永刚教授、张亚敏教授、欧阳伟教授等人研究开发了一种毫米级的、生物可吸收的光电装置,其集成自供电与无线光控机制,不仅具备临时心脏起搏功能,还可应用于神经与骨骼再生、伤口愈合及缓解疼痛等多种电疗场景。
2025年4月2日,相关工作在Nature期刊上发表了题为“Millimetre-scale bioresorbable optoelectronic systems for electrotherapy”论文。美国西北大学博士后张亚敏(2024年任职于新加坡国立大学助理教授)为第一作者兼通讯作者,美国西北大学John A. Rogers教授、Igor R. Efimov教授、黄永刚教授及芝加哥大学Rishi Arora教授、达特茅斯学院助理教授欧阳伟为共同通讯作者。
临时心脏起搏器适用于短期心跳过缓的患者。传统的临时起搏器须经血管或者通过开胸手术放置起搏导线,通过侵入性的开胸手段会造成比较大的创口,而血管放置手段不适用于儿童以及不适合血管植入的病人。因此临时起搏器带来了诸如异物排斥、长期电池依赖、手术创伤大等难题。

该心脏起搏器尺寸仅为1.8毫米×3.5毫米×1毫米
这种可注射及可降解的微型临时心脏起搏器。其大小(1.8 mm × 3.5 mm × 1 mm)与米粒相当,支持其以微创方式植入,能最大限度地减少装置对患者的负荷和植入手术的风险,并能为新生儿提供治疗的可能性。除此之外,该款装置的各组件均应用了可被生物降解与吸收的材料,因此,在完成心脏起搏任务后,装置将自行在体内逐渐降解,在1至2.5年的尺度下经由肾脏排出体外,从而完全规避了为取出装置而进行的二次手术,进一步降低了装置的使用风险。
核心创新:电池与生物系统的完美整合
这一突破性研究的技术核心在于其将微型电池、光电传感器与生物组织有机结合,由张亚敏博士提出。同需要起搏导线连接独立电源的传统起搏器不同,该款装置直接利用了电池电极作为起搏电极,并以人体体液/组织作为电解液,实现体内植入后的自供电,无须任何外在能源即可支持装置的正常运行。
亮点介绍
本装置集成了微型光控开关,用“光”远程无线控制起搏器来实现精准的心律控制。我们选用了850 nm的近红外光,光源只需要放置在心脏上方的皮肤表面,便可控制体内起搏器(植入6厘米深度以下)的工作。同时,还开发了一款体外可穿戴的皮肤贴片(欧阳伟教授设计)来控制体内的起搏器。这种皮肤贴片既能提供可编程的近红外光照射,同时也集合了心电图数据收集和分析功能,可进行实时的智能心律监控。在检测到心律异常后,皮肤贴片将自动启动近红外光的照射功能引发起搏,从而实现该系统的完全自主闭环控制。最后,为验证该系统进行心脏起搏的有效性,研究团队在小鼠、大鼠、猪、犬(体内)和人(体外)的心脏模型中均完成了可控制的起搏工作。
临床前景:适用于心律失常患者以及与TAVR系统集成
将该系统与皮肤器件设备配对,可在检测到心律失常时进行自主闭环心脏电疗;与经导管主动脉瓣置换术(TAVR)系统集成,可在瓣膜置入期间提供快速起搏以及术后提供常规起搏。
未来展望:交叉学科融合,推动医疗科技发展
该研究综合了电池技术、光电技术、微纳制造、生物相容性材料等多学科前沿技术,实现了新一代起搏器的开发。这项创新不仅推动了心血管疾病植入器械的发展,也为未来可植入器件、组织穿透无线控制等方向提供了新的思路。同时,这种全新的“无创、智能、自主供能”植入设备模式可为精准医疗带来新的可能。
图文解析
(图1)详细介绍了起搏器的设计。该设备非常紧凑(1.8毫米×3.5毫米×1毫米,大约是一粒米的大小),并使用电池电极作为起搏电极。阳极材料包括生物可吸收的镁(Mg)或锌(Zn),与三氧化钼(MoO3)阴极配对。周围的心脏组织充当电解质,从而形成原电池。光学控制通过硅双极结光电晶体管进行管理,由外部来源的近红外(NIR)照明激活。重要的是,生物可吸收结构可确保患者风险最小,并且无需进行拔除手术。
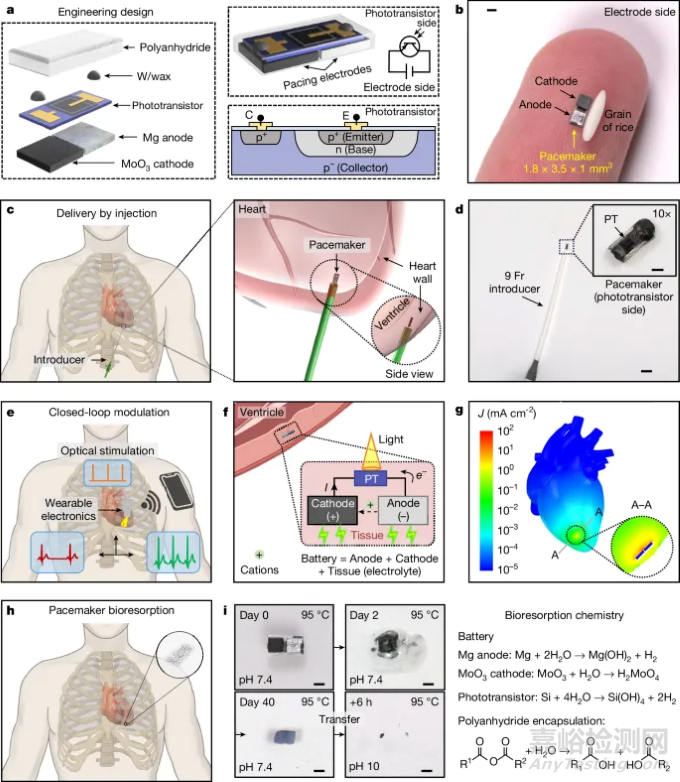
图1. 具有无线光电控制的可注射、自供电、生物可吸收心脏起搏器的设计
起搏器具有快速响应能力(图2),通过NIR光的可变强度和脉冲宽度实现对起搏的精确控制。在Langendorff灌注的猪和人类心脏上进行的体外实验建立了强大的起搏能力。这些实验的关键电生理数据包括成功的捕获阈值(例如,基线电流为~0.18 mA,时效性为~2.8 ms),表明可靠的起搏性能适合临床应用。心电图记录进一步证明了成功的多部位起搏潜力,这对于心脏再同步等先进疗法至关重要。
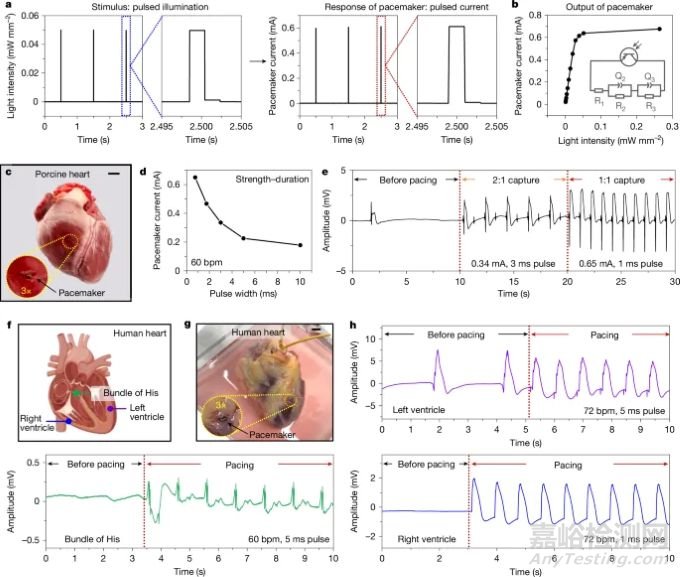
图2. 人类和猪心脏的光电特性和体外起搏
通过使用犬类模型体内演示了这些起搏器的可行性(图3)。蒙特卡罗模拟验证了近红外光照射在临床相关深度(高达40毫米)下穿透生物组织的穿透效率,确保起搏器在安全阈值内激活。实际演示涉及荧光透视引导的微创注射技术,使起搏器能够部署到心外膜下心肌层中。心电图数据证实起搏成功,速度为240 bpm,并具有稳定的1:1捕获率,强调了起搏器在闭胸场景中的实际适用性。起搏寿命被证明可以可靠地延长超过典型的临时起搏需求的时间(Zn-MoO3设备最长可达20天)。

图3.犬模型中起搏器注射和闭胸起搏的体内演示
进一步扩展了多部位起搏,通过使用放置在光电晶体管顶部的光学滤波器的波分复用(WDM)来实现(图4)。这允许精确控制不同心脏部位的单个起搏器而不会产生干扰。在多个部位(例如左心房和心室)成功起搏显示出重要的临床意义,例如双心室和双腔起搏,显著改善了心室同步和生理上准确的起搏模式,这对于治疗充血性心力衰竭等疾病至关重要。
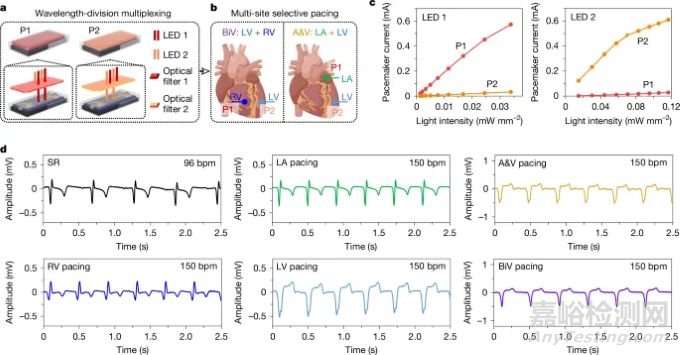
图4. 犬模型中多部位、时间同步起搏的体内演示
描述了这些起搏器与能够自主电疗的无线皮肤接口设备的创新集成(图5)。该设备监测心电图信号,自动检测心律失常并启动起搏反应。在大鼠模型中进行的实验通过检测心动过缓(低于220 bpm)并随后以240 bpm的校正速率起搏,成功展示了闭环操作。这种整合标志着朝着自主、患者响应式心脏护理迈出了重要一步。
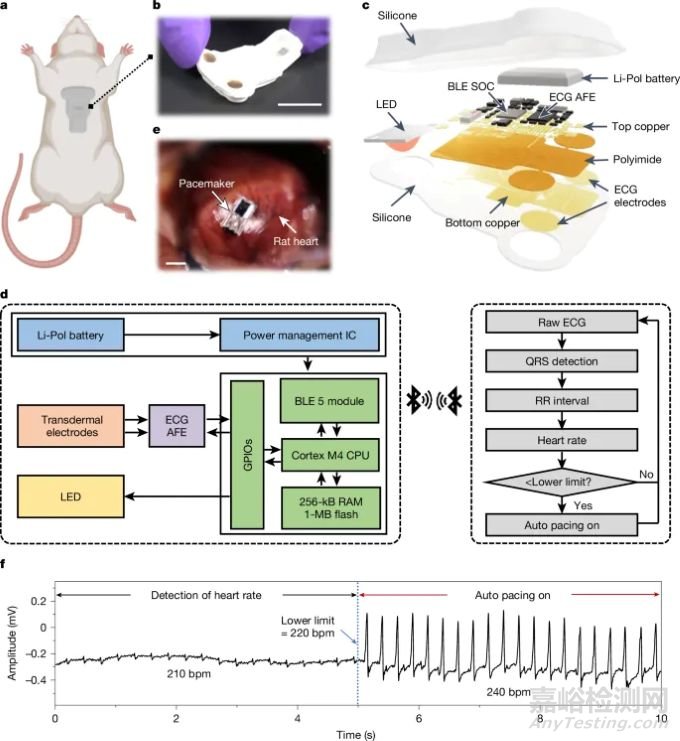
图5. 用于闭环心脏电疗的无线皮肤接口光电系统设计
还探索了将这些微型起搏器直接集成到经导管主动脉瓣置换术 (TAVR) 支架上的独特应用(图6),解决了常见的术后传导障碍。在 TAVR 支架框架周围战略性放置的多个起搏器有效地在体外人体心脏中提供了心室起搏。心电图评估显示从瓣膜周围选定的位置成功起搏,证实了这种集成方法的临床可行性。这种整合提供了一种有效管理术后传导障碍的新颖解决方案,可能通过简化术后护理来改变患者的治疗结果。
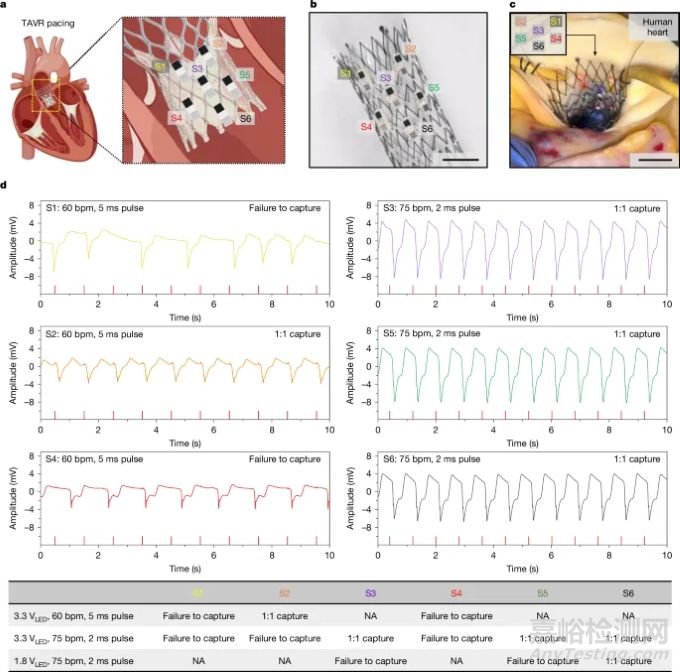
图6. 在人体心脏中使用与TAVR瓣膜集成的一组起搏器进行心脏起搏的体外演示
总之,重点介绍了一种革命性的临时心脏起搏技术,利用生物可吸收的光电系统,在安全性、微创性和临床疗效方面具有显著优势。所展示的多部位同步起搏和与TAVR等先进心脏手术的集成有望显著改善心脏治疗的临床护理,并为再生医学和电疗法的更广泛应用铺平道路。
关于制造过程中的挑战,John A. Rogers教授表示:“自供电方法的概念是关键,同时还需要一个光学方案来控制设备。” 他坦言,自供电概念是由当时中国博士后张亚敏提出的。在美国佐治亚理工学院攻读博士学位时,张亚敏研究电池技术,将这一想法带入项目,促成了这一创新。
本次研究主要在动物模型和离体人体心脏组织上进行了验证。至于未来在活体患者身上的应用,John A. Rogers教授表示需经过监管流程,“任何这类救生植入物都必须通过严格的监管流程”。此外,John A. Rogers教授表示,已有初创公司开始推动该研究的临床转化。
John A. Rogers教授预计在两三年内启动首次人体植入的研究,使这一技术进入临床试验阶段,最终成为医生日常使用的工具,为心动过缓患者带来一项新型治疗选择。
原文链接
https://www.nature.com/articles/s41586-025-08726-4

来源:化学与材料科学


