您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-02-10 15:32
作者|韩天娇1,胡玉玺2,付宏征1*(1北京大学药学院 天然药物及仿生药物国家重点实验室,2CDE)
修饰已上市药物以改善药物存在的缺陷,是目前全球药物研发的一个重要方向。以高分子前药为基础的给药系统具有前药修饰和微纳米载药的双重优势,可以增强药物在体内、体外的稳定性,增加药物的靶向性,提高药物的生物利用度、降低药物不良反应和提高治疗效果。本文根据高分子前药的研发机制,从被动靶向、主动靶向、触发释药和协同给药进行综述,探讨该类药物的研发现状及所面临的问题,并对此给出适当可行的解决方案。
随着对人类致病机制的不断认识,潜在的靶点已基本被全面开发,每一个疾病领域新靶点的发现会带来该疾病治疗手段的突破性革新。新靶点的开发受到人类认知水平、技术表征水平等多种因素的限制,近年所开发出的全新药物相对较少。对已上市药物的二次开发,包括利用前药修饰、制备微球等特殊制剂已成为研发热点。
1 被动靶向前体给药系统
基于高分子前药的被动靶向给药系统主要是根据肿瘤的病理、生理特征开发出来的给药技术,特别是利用高渗透性和滞留( EPR) 效应促进药物在肿瘤细胞的累积[10]。EPR 效应产生的主要原因是肿瘤部位较正常组织有显著的区别,其血管丰富、血管壁间隙较宽、淋巴循环系统缺失。可供担载药物的高分子化合物种类繁多,但需满足如下条件: 具有活性官能团、生物相容性好、无毒及免疫原性、可在体内降解或清除等。最常用的聚合物包括聚乙二醇( PEG) 、聚N-( 2-羟丙基) 甲基丙烯酰胺( HPMA) 、聚乳酸( PLA) 、聚氨基酸、多聚糖,等。单一结构单元的高分子在载药量、药物传递效率等方面难以满足需求,利用特殊的聚合手段,合成含有不同结构链段的高分子化合物,是近年来研究比较多的高分子载体[11]。根据骨架结构,用于合成高分子前药最常用的聚合物主要包括3 类: ( 1) 嵌段共聚物; ( 2) 树枝状聚合物; ( 3) 梳状聚合物。这些聚合物共同的特点是在聚合物的骨架上存在大量的、数量可调控的活性官能团,可与抗肿瘤药物的活性官能团反应,在实现较高的载药量的同时也可以调节载药量,另外不同结构链段的理化性质的差异可以赋予高分子前药很多独特的性质。如PEG 与疏水性多官能团的高分子化合组成嵌段共聚物后再与药物耦合,此时药物分子被聚集在疏水中心,能够得到很好的保护,同时PEG 分子链在外层可以提供长循环所需要的水化层,避免被网状内皮系统快速消除,起到“隐身”的作用[12]。
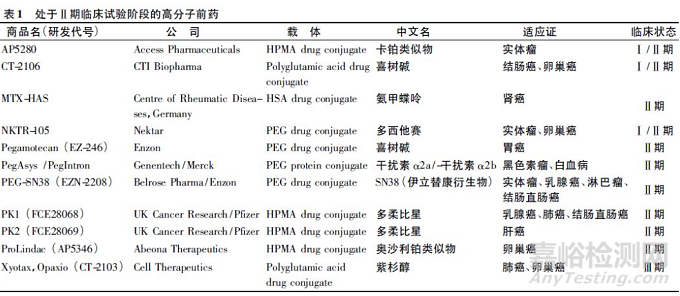
如表1 所示,多种高分子前药已经进入了Ⅱ期临床研究。这些药物在降低毒性,提高靶向性等方面都表现出了一定的优势,如SN38( 7-乙基-10-羟基喜树碱) 是伊立替康的活性代谢产物,具有严重的细胞毒性,由于其水溶性低,不能经静脉注射给药。由Enzon 公司开发的利用多臂PEG 与4 个SN38 成键,可以实现高载药量和良好的水溶性,具有很好的肿瘤组织分布特征、良好的耐受性,抗肿瘤活性明显增强,目前正在美国、日本同时开展Ⅱ期临床研究[13]。
由于肿瘤细胞的异质性和结构的复杂性,单纯依靠EPR 效应实现的被动靶向作用不能有效地将活性药物分子运输到肿瘤细胞内部,同时被动靶向药物会在具有孔窗的内皮细胞上累积( 如肝、脾) ,细胞毒性药物的副作用不能得到充分的控制。因此,开发靶向性更强、治疗效果更好的新一代药物传输体系具有重要意义。
主动靶向前体给药系统通过将高亲和力的靶向配体连接到高分子前药上,当药物富集在肿瘤组织周围后,配体可以识别靶细胞,促进药物向细胞内的转运,使靶细胞内的药物浓度增大,提高药物治疗效果。靶向递送应保证配体与其同源受体的高特异性,配体以特定的方式结合到靶细胞上,同时最小化结合于健康细胞[14]。
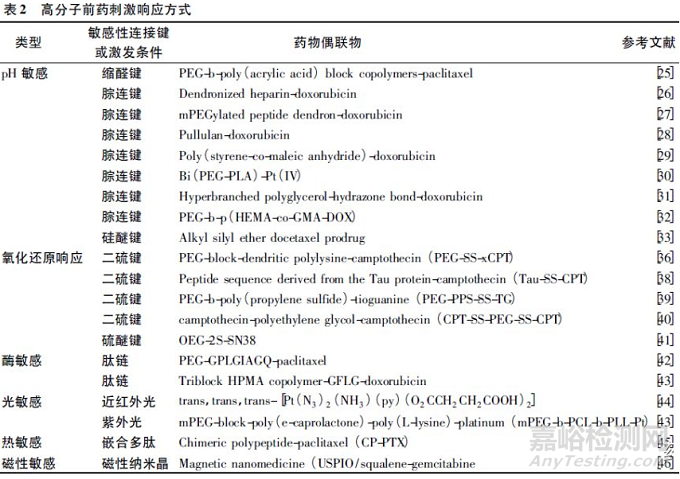
3. 1 pH 敏感高分子前药
在常用的刺激触发药物释放策略中,pH 响应是近些年来最受关注的给药手段[23]。pH响应的高分子前药具有酸触发释放药物的特点,在系统循环的正常pH 范围内,可以共价结合抗肿瘤药物,在偏酸的肿瘤组织( pH 6. 5 ~ 7. 0) 和肿瘤细胞内( pH 5. 0 ~ 6. 5)中迅速释放药物[24]。酸触发药物释放可以通过应用pH敏感的可生物降解的化学键实现,主要包括缩醛键[25]、腙键[26- 32]和硅醚键[33]。如,缩醛键连接的紫杉醇和聚乙二醇-聚丙烯酸嵌段共聚物( PEG-PAA) 前药在酸性的内吞体/溶酶体中药物快速释放[34]。体外释放实验显示紫杉醇的释放行为有明显的pH 依赖性,在pH 分别为5. 0、6. 0和7. 4 时溶出度分别为86. 9%、66. 4%和29. 0%。
一些在肿瘤中过度表达的特定的酶对于用作抗肿瘤传递刺激物具有广泛前景。在高分子前药的设计中,组织蛋白酶B、基质金属蛋白酶-2 等都可作为响应载体。其中,如今研究较多的基质金属蛋白酶-2( MMP-2) 在肿瘤细胞中过度表达,它与肿瘤生长、侵袭和转移密切相关[37]。通过在PEG 和紫杉醇中间引进的可被MMP-2特异剪切的八肽(GPLGIAGQ) ,制备MMP-2 敏感的PEG2000-紫杉醇偶联物,该药物在体内和体外的抗肿瘤活性比无刺激敏感的
除了以上提到的根据肿瘤内部环境特点开发的高分子前药触发释药系统外,部分对外界刺激敏感的偶联药物也被设计并合成出来。其中,光、热和磁都被用来作为药物释放的刺激条件。比如,开发的光敏感铂( Ⅳ) -氧化物前药纳米组装体能够通过UVA 射线的辐射实现活性Pt(Ⅱ)在肿瘤部位的选择性激发。与顺铂、奥沙利铂和游离的前药相比,光敏感铂( Ⅳ)前药纳米粒有更显著的抗卵巢癌SKOV-3细胞的作用。重要的是,光敏感铂( Ⅳ) 前药纳米粒和小分子的母药物相比具有更低的系统毒性和更强的小鼠H22 肝癌肿瘤生长抑制作用[47]。
4 基于高分子前药的协同给药体系
5.1 高分子载体的设计
5.2 连接臂的选择
5.3 连接活性药物的质控及表征
在与高分子载体连接之前,活性药物一般可通过有效的表征手段进行精确的结构确证,可建立其完善的质控体系。而与高分子载体链接之后,一般无法有效地确证其结构,同时也意味着无法有效表征其可能产生的杂质。因此加强链接之前的活性药物和载体的质控以及反应过程控制显得尤为重要。应充分评估活性药物的杂质水平,尤其对具有活性位点可与链接臂发生反应的杂质应该重点评估。由于杂质与连接臂的反应活性可能高于活性药物,可能大量的引入到目标药物中,可以先对连接臂上与高分子载体连接的基团利用惰性小分子基团封端,然后与药物分子模拟反应条件进行考察。由于药物与改构的连接臂反应后,可以得到结构明确的化合物,对其进行详细分析可以判断活性药物的杂质水平和拟定的反应条件是否合理。同时为了提高活性药物修饰后的纯度,降低残留的未偶联药物的高分子载体数量,一般会采取活性药物多投料的方法,使高分子载体活性反应位点尽可能地反应完全,之后采用透析等手段除去小分子药物。但是高分子载体上潜在的未反应官能团由于引入了活性团,而对药物存在一定影响,可通过滴定等手段对潜在的高分子链上未反应的活性位点进行评估,使其对药物的影响降到最低。高分子载体修饰之后的活性药物,精确表征其结构存在一定难度。除上述应尽量加强过程控制保证得到预期的高分子前药之外,需尽可能地采用适当的表征手段对特性结构进行考察。对于修饰之后的药物,因保留了修饰前活性药物的大部分结构特征,所以在一些传统结构确证手段上具有一定的相似性,同时活性药物与连接臂、连接臂与高分子载体链接的过程中可能产生新的官能团,可通过相应的表征手段进行鉴定。例如修饰前后的药物红外光谱具有类似的活性药物结构的吸收峰,同时与连接臂形成的酯键等新官能团也可以被检测。一般情况下,高分子担载前药均具有一定的空间结构,粒子属性应是关注的重点。高分子前药是否具有自组装成微球的性质,批内粒子均一性,批间粒子一致性等均需进行详细的研究。可采用电镜等分析方法利用统计学手段对粒子属性进行充分的评估。
5.4 高分子前药的特性考察

来源:Internet


