您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-06-02 11:33
1什么是基因毒性杂质
基因毒性杂质(或遗传毒性杂质,Genotoxic Impurity ,GTI)是指化合物本身直接或间接损伤细胞DNA,产生基因突变或体内诱变,具有致癌可能或者倾向。潜在基因毒性的杂质(Potential Genotoxic Impurity ,PGI)从结构上看类似基因毒性杂质,有警示性,但未经实验证明的黄曲霉素类、亚硝胺化合物、甲基磺酸酯等化合物均为常见的基因毒性杂质,许多化疗药物也具有一定的基因毒性,它们的不良反应是由化疗药物对正常细胞的基因毒性所致,如顺铂、卡铂、氟尿嘧啶等。
2为何着重研究基因毒性杂质
基因毒性物质特点是在很低浓度时即可造成人体遗传物质的损伤,进而导致基因突变并可能促使肿瘤发生。因其毒性较强,对用药的安全性产生了强烈的威胁,近年来也越来越多的出现因为在已上市药品中发现痕量的基因毒性杂质残留而发生大范围的医疗事故,被FDA强行召回的案例,给药厂造成了巨大的经济损失。例如某知名国际制药巨头在欧洲市场推出的HIV蛋白酶抑制剂维拉赛特锭(Viracept, mesylate),2007 年7月,EMA暂停了它在欧洲的所有市场活动,因为在其产品中发现甲基磺酸乙酯超标,甲基磺酸乙酯是一种经典的基因毒性杂质,该企业为此付出了巨大的代价,先内部调查残留超标的原因,因在仪器设备清洗时乙醇未被完全清除而残留下来,与甲基磺酸反应形成甲基磺酸乙酯。在被要求解决污染问题后还被要求做毒性研究,以更好的评估对患者的风险。同时有多达25000 名患者暴露于这个已知的遗传毒性。直到解决了这所有问题后 EMA才恢复了它在欧洲的市场授权。
近年来各国的法规机构如ICH、FDA、EMA等都对基因毒性杂质有了更明确的要求,越来越多的药企在新药研发过程中就着重关注基因毒性杂质的控制和检测。
3哪些化合物是基因毒性杂质
杂质的结构多种多样,对于绝大多数的杂质而言,往往没有充分的毒性或致癌研究数据,因而难以对其进行归类。在缺乏安全性数据支持的情况下,这些法规和指导原则采用“警示结构”作为区分普通杂质和基因毒性杂质的标志。对于含有警示结构的杂质,应当进行(Q)SAR预测和体内外遗传毒性和致癌性研究,或者将杂质水平控制在毒理学关注阈(TTC)之下。
目前,一般将致癌物分成两大类:一类是遗传毒性致癌物,通过化学键合直接破坏遗传物质产生致癌性, 大多数的化学致癌物具有遗传毒性; 第二类是非遗传毒性致癌物, 通常不与发生化学键合作用, 不对产生直接破坏, 而是通过遗传物质外的间接机制引起致癌作用( 如促进细胞过度增殖等)。
将多个文献中的警示结构汇总于(见原文PDF)。关于基因杂质警示结果的具体详细信息另外可参考欧盟发布的警示结构《Development of structure alerts for the in vivo micronucleus assay in rodents》。或进入 The Carcinogenic Potency Database (CPDB),里面有 1547 种致癌物质的列表,结构式,CAS 号,作用部位,TTC 值等一系列信息。应当注意, 含有警示结构并不意味着该杂质一定具有遗传毒性, 而确认有遗传毒性的物质也不一定会产生致癌作用。杂质的理化性质和其他结构特点(如相对分子质量、亲水性、分子对称性 / 空间位阻、反应活性以及生物代谢速率等)会对其毒性产生抑制或调节作用。警示结构的重要性在于它提示了可能存在的遗传毒性和致癌性, 为进一步的杂质安全性评价和控制策略的选择指明方向。
4对基因毒性杂质的法规要求及限度
最初,ICH相继推出的原料药杂质研究指导原则Q3A(R2)、制剂杂质研究指导原则 Q3B(R2),在这些指导原则中提及“对于能够产生强的药理活性或毒性的潜在杂质,即使其含量低于0.1%,仍然建议进行结构鉴定研究”。在之后的修订版中,还进一步明确“要关注原料药中的潜在遗传毒性杂质”,以及“对于毒性非常强的杂质,可能需要制定更低的限度”,但是其中并未明确阐述遗传毒性杂质的研究和控制问题,也未提出具体的研究原则、控制策略和限度要求。
在EMA(欧洲药物评审组织)推出《遗传毒性杂质限度指导原则》, 引入了可接受风险的摄入量,即毒性物质限量,或称毒理学关注门槛(TTC,Threshold of Toxicological Concern)这个概念。设置了限度值 TTC(1.5 µg/day),即相当于每天摄入1.5 µg的基因毒性杂质,被认为对于大多数药品来说是可以接受的风险(一生中致癌的风险小于十万分之一)。按照这个阈值,可以根据预期的每日摄入量计算出活性药物中可接受的杂质水平。需要指出的是TTC是一个风险管理工具,它采用的是概率的方法。假如有一个基因毒性杂质,并且我们对它的毒性大小不太了解,如果它的每日摄入量低于 TTC 值,那么它的致癌风险将不会高于10-5 的概率,TTC不能被理解为绝对无风险的保障。在特定的条件下一些基因毒性杂质也可以有较高的阈值。如接触时间比较短等,这个需要根据实际情况再进行推算 。最近出台的ICH M7《Assessment and Control of DNA Reactive (Mutagenic) Impurities in Pharmaceuticals to Limit Potential Carcinogenic Risk》中较为详尽的阐明了如何使用TTC值,如何设定质量标准。下面就简要介绍ICH M7指导原则中的内容。
已经建立的TTC概念,用于界定所有未经研究,但具有致癌风险或其它毒性效果的化学品的可接受摄入量。基于TTC的方法一般被认为是非常保守的,因为它们牵涉到从给定的50%肿瘤发生率(TD50)简单线性外推到十万分之一发生率,且采用的数据是来自于最敏感物种和最敏感肿瘤部位的TD50数据。在使用TTC评估原料药和制剂中诱变性杂质的可接爱标准时,可以采用1.5 µg/天对应于十万分之一生命时长患癌风险。但有些结构基团被识别为具有较高的效价,因此即使摄入量低于TTC 水平,从理论上来说仍会导致可能的显著癌症风险。这类具有较高效价的基团被称为“关注队列”,包括黄曲霉素类、N-亚硝基化合物,以及烷基-氧化偶氮基化合物。基于上述这些原因,应进行风险评估来决定是否需要采取进一步行动。根据诱变性和致癌性,可将杂质分为五类,采用不同的控制措施,如下表。
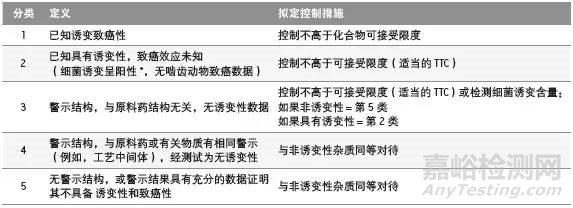
应采用(Q)SAR 方法进行计算学毒性评估,预测细菌诱变含量的结果。要使用两个相互补充的(Q)SAR 预测方法。一个方法应是依据专家规则的,另一个方法则应该是统计方式的。两个互补的(Q)SAR 方法(专家规则和统计学)如果没有发现结构警示,则足以得出结论该杂质没有诱变可能,不需要做进一步的检测。
在对有关的警示结构(第3类)进行确认之后,可以采用充分的控制措施,或者对该杂质单独进行细菌诱变测试。如果所得的细菌诱变测试结果为阴性,则可以推翻基于结构的疑虑,这时不建议进行进一步的基因毒性评估。这些杂质应被当作非诱变性杂质(第5类)。如果细菌诱变测试为阳性,则要进行进一步的危害性分析或采取控制措施(第2类)。
如果一种杂质具有与药用物质或相关化合物具有相似的警示结构(例如,在相同位置和相同化学环境下具有相同警示结构),且该物料的细菌诱变测试为阴性,则该杂质可以被认为是非诱变性的(第4类)。
根据 TTC 计算可接受摄入量时,一个具有诱变性的杂质每天每人摄入1.5 µg时其风险被认为是可以忽略的(终生暴露情况下理论的患癌风险小于十万分之一),可以通用于大部分药物,作为默认的可接受限度控制标准。该方法一般用于长期治疗用药物中的诱变性杂质(>10年),且没有致癌数据时(第2类和3类)。
因基因毒性杂质毒性较大,须在工艺过程中对相关杂质进行控制。在ICH M7 中也对工艺控制给出了方法。
第一种方法
在原料药质量标准中加入杂质检测并制订质量标准,利于适当的仪器分析方法。根据ICH Q6A,方法1控制方式可以适用定期检测。如果原料药中的诱变性杂质在至少6个连续的中试批次或3 个连续的生产批次中,测得结果均低于可接受限度的30%,则可以论述进行定期检测。如果不满足该条件,则建议对原料药进行常规检测。
第二种方法
在原料、起始物料或中间体的质量标准中包括对杂质的检测,或作为中控检测,同时制订可接受标准,或采用适当的分析方法,将杂质控制在可接受限度以下。
第三种方法
在原料、起始物料或中间体的质量标准中包括对杂质的检测,或作为中控检测,同时制订一个高于原料药中可接受限度的质量标准,采用适当的分析方法,配合经过证明杂质致命知识,杂质在后续工艺中被清除的知识,并对后续工艺进行控制,保证原料药中的该杂质残留水平低于可接受限度,而不需要在后续工艺中再行检测。当实验室级试验(鼓励采用加样试验)数据,必要时可以采用中试生产或商业批次数据加以支持,显示原料药中杂质水平低于可接受限度的30% 时,可以采用该方法。
第四种方法
对工艺参数和残留杂质水平(包括致命性和清除知识)影响有了解,确信原料药中的杂质一定会低于可接受限度,此时,建议该杂质不需要进行分析测试(例如,不需要将杂质列在任何质量标准中)。如果生产工艺的化学特性和工艺参数对诱变杂质的影响水平是已知的,并且最终原料药中杂质残留超出可接受限度的风险已经评估并认为是可以忽略的,那么可以采用对工艺的控制来取代采用分析方法控制。在很多情况下,只需要根据科学原理对该控制方法进行论述就可以了。科学风险评估要素可以用来论证第4种方法。可以根据对杂质去向和消除产生影响的理化特性和工艺因素,包括化学反应性、溶解性、挥发性、离解性和所有用于去除杂质的物理处理步骤进行风险评估。该风险评估的结果可以用来作为杂质被工艺所清除的预估因子。第4种方法特别适用于那些本质上来说就不稳定的杂质(例如亚硫酰氯与水迅速完全反应),以及那些在合成路线早期引入,但已被有效清除的杂质。有些情况下,如果已经知道杂质是在合成后期引入或形成的,则也可以采用第4种方法,但这时,需要提交与工艺相关的数据来论述该方法的合理性。
在ICH M7中,除了给出这四种参考控制方法,还对具体用哪种方法,对哪些因素进行考虑,以及上市申报CTD需要提供哪些依据文件等,给出了一些具体说明,在此处不再累述。
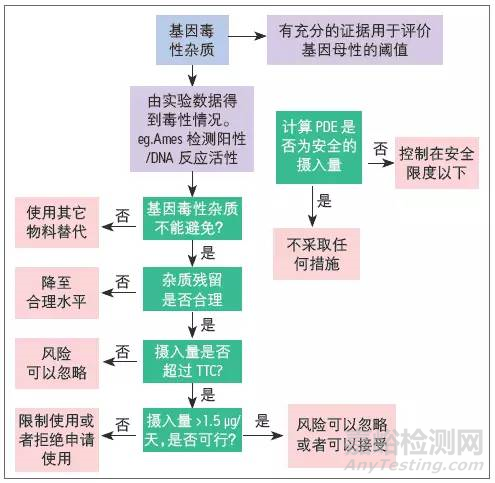
基因毒性杂质检测决策树
3如何检测基因毒性杂质
如前章所述,针对杂质的不同毒性、服药期长短等,设置不同的阈值,则需要相应不同检测手段,即开发拥有不同的检测限的分析方法。
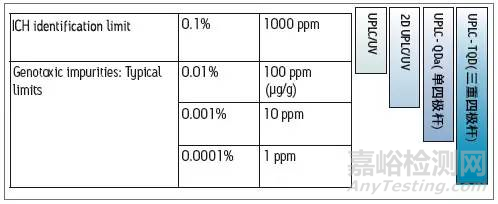
下面就分别介绍这几种检测手段的特点:
相同的化合物,使用UPLC代替HPLC,不仅检测速度增加,灵敏度也会提升好几倍,所以使用UPLC/UV对常规限度较高的基因毒性杂质都会有较好的效果。
如使用UPLC/UV 方法检测苯磺酸氨氯地平样品中的苯磺酸甲酯(MBS)和苯磺酸乙酯(EBS),在苯磺酸氨氯地平样品中加标15 ppm MBS和EBS六次进样的叠加谱图。
可看出,对这一特定样品,UPLC/UV检测即可达到FDA和EMEA对MBS和EBS 的检测水平要求。
当然,与UPLC相连的检测器也不局限于UV,根据化合物特性,如待检测杂质有荧光发色基团,则可使用荧光检测器与超高效液相连接,得到较好的灵敏度。
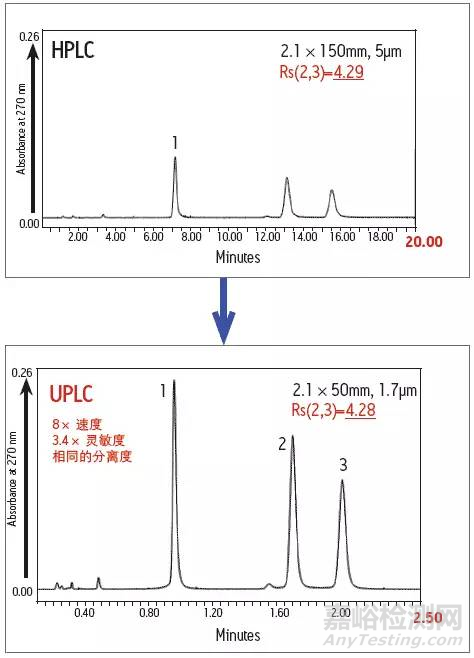
由HPLC转化成UPLC方法,检测速度和灵敏度都会大幅提升
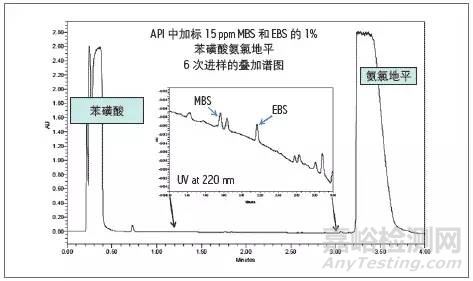
加标15 ppm苯磺酸甲酯和苯磺酸乙酯的苯磺酸氨氯地平样品的UV分析
2D UPLC系统由两个溶剂管理器、一个样品管理器、一个色谱柱管理器和检测器共同组成。它的应用广泛,在药物领域中,最常用到的即为进一步增加分离度、增加灵敏度的功能。
使用UPLC二维技术,可以通过增大进样量的方式来提高灵敏度。使检测限在UPLC/UV的基础上进一步提升。
在一维体系中,大体积进样,并将目标杂质和API有最基本的分离,然后将目标杂质(下图中绿色部分)切入二维进一步分离,得到无干扰的目标杂质峰,进行定量更准确。从下图的定量检测结果可看出,即使在5 ppm的较低含量下,也有较好的回收率。
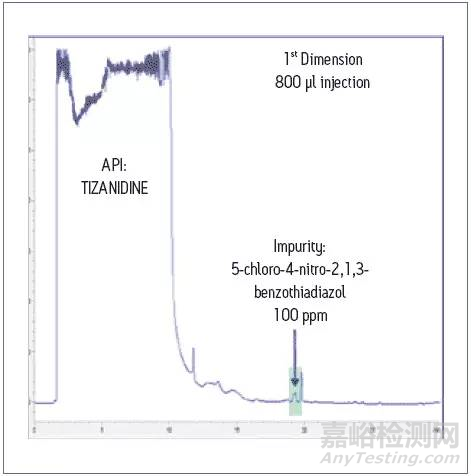
大体积进样提高灵敏度,将第一维中绿色部分切入到二维体系中
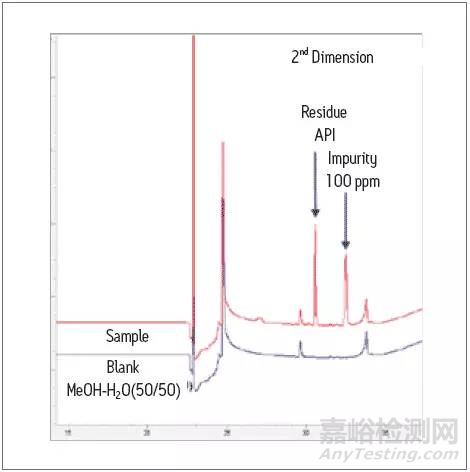
在二维中进一步分离并定量
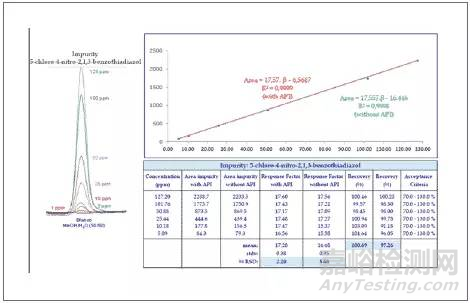
二维中杂质定量结果
使用UPLC/UV检测器检测基因毒性杂质,虽然对目标杂质会有较好的响应,但因其中API的浓度很高,且API中包含的其他杂质很可能会对目标的基因毒性杂质产生干扰,即有些杂质与目标基因毒性杂质有相同或将近的保留时间,易出现假阳性或回收率不好的现象。所以说UPLC/UV的方法抗干扰能力及假阳性率会比较高。
而使用超高效液相与质谱检测器连接,就可以很好的解决此问题。使用质谱检测器不但能得到更好的灵敏度而且抗干扰能力更强。
Waters研发的新型质谱检测器QDa,单四极杆、拥有一般质谱的功能,可用于定性和定量;其体积小巧,与UV检测器大小相同;一键式开关,即开即用型,开机后仪器自动校准,一刻钟真空即可抽好;软件参数设置简单;成本低且维护成本也低;利于研发与QC间方法转移。
使用UPLC/UV检测苯磺酸氨氯地平样品中加标15ppm MBS和EBS六次进样的叠加谱图。使用单四极质谱检测器检测结果见下图,其抗干扰能力大大增加。
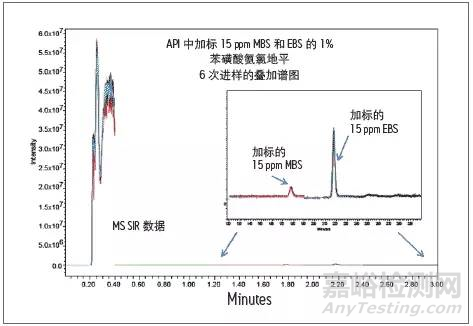
加标15 ppm苯磺酸甲酯和苯磺酸乙酯的苯磺酸氨氯地平的MS分析
当追求更低的检出限时,具体更高灵敏度的三重四极杆,常常是用户的最佳选择。Waters有多种型号的三重四极杆可供用户选择,强大稳定且久经验证的Xevo TQD、有进一步提高灵敏度和耐用性的Xevo TQ-S micro、还有迈向极致灵敏度的Xevo TQ-S。一般情况下,使用Xevo TQD三重四极杆就可以完全满足基因毒性杂质的检测限要求。采用Xevo TQD质谱仪检测甲磺酸,可轻松测定至0.1 ng/mL的浓度。
三重四极杆可通过多反应监测(MRM)模式借助MS/MS功能来实现极致的定量,如达到ppb级别,甚至是ppt级别。并且软件有自动开发功能,自动查找最佳的MS/MS离子对和碰撞电压。通过软件的定量工作流程使整个分析从头到为都是最简化最快速。
同时可使用“RADAR”功能,查看基质对杂质检测的干扰情况,使用户能够全面了解情况,进而更快速更有信心的开发方法。
借助子离子确认扫描(PICs)这一功能,用户在做定量检测的同时,可通过PICs 自动触发子离子扫描,得到其二级碎片谱图,用于对目标化合物的进一步确证。
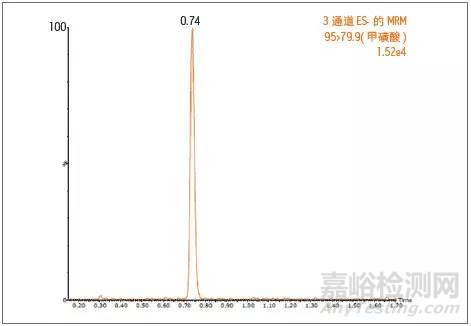
使用UPLC/Xevo TQD 检测0.1 ng/mL 的甲磺酸
随着对杂质定性方面的要求更多,越来越多的用户也会考虑使用飞行时间质谱对基因毒性杂质进行检测。

来源:Internet


