您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-07-28 09:58
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
阿斯利康与第一三共再次携手开发抗体偶联药物。7月27日,阿斯利康与第一三共制药就TROP2靶向抗体药物偶联物(ADC)DS-1062达成一项新的全球开发和商业化协议。DS-1062目前正在开发用于治疗表达TROP2的多种肿瘤。根据协议,阿斯利康将向第一三共支付10亿美元分期付款,药物获批上市后高达10亿美元的额外付款,以及高达40亿美元的销售相关里程碑款项;两家公司将在全球除日本外共同开发和商业化DS-1062,第一三共将保留在日本独家开发的权利;第一三共将负责DS-1062的制造和供应。
国内药讯
1.辉瑞克立硼罗软膏即将在中国获批。辉瑞在中国提交的特应性皮炎新药克立硼罗软膏上市申请进入行政审批阶段,有望近期获批。克立硼罗(商品名为Eucrisa)是Anacor公司开发的一款非甾体PDE4抑制剂,辉瑞于2016年5月斥资52亿美元收购该公司获得此药物,同年12月,克立硼罗获得FDA批准上市,成为10年来首个获批上市的特应性皮炎处方药,也是首个抑制皮肤PDE4的非甾体外用药物。2019年,Eucrisa销售额为1.38亿美元。
2.豪森药业恩格列净首仿即将获批。豪森药业4类仿制药恩格列净片上市申请进入“在审批”阶段,有望近期获批成为国内首仿。恩格列净是勃林格殷格翰开发的一款SGLT-2抑制剂,目前已获批用于2型糖尿病患者的治疗,以及用于降低伴有心血管疾病的成人2型糖尿病患者的心血管死亡风险。原研产品已于2017年9月获批进入中国,商品名为欧唐静 。中国目前已有卡格列净、达格列净和恩格列净3款SGLT-2抑制剂获批上市,并均被纳入医保乙类目录。其中,恩格列净国内中标价中值为9.75元/10mg。
3.阿斯利康/辉瑞「头孢洛林酯」即将在华获批。7月24日,阿斯利康与辉瑞联合开发的注射用头孢洛林的上市申请进入行政审批阶段,有望近期在中国获批上市。头孢洛林酯(Zinforo)属于第五代抗生素,于2010年10月获得FDA批准上市,用于治疗急性细菌性皮肤/皮肤结构感染和社区获得性细菌性肺炎。阿斯利康此前持有Zinforo在全球地区(北美和日本除外)商业化的权利,2016年8月,辉瑞通过授权获得了阿斯利康包括Zinforo在内的多款抗感染药物美国以外市场权益。
4.默沙东艾托格列净即将在中国获批。7月24日,默沙东在中国提交的艾托格列净片上市申请进入“在审批”阶段,有望近期获得批准,成为中国获批上市的第4款SGLT-2抑制剂。艾托格列净是FDA继卡格列净(强生)、达格列净(阿斯利康)、恩格列净(勃林格殷格翰/礼来)后批准上市的第4款SGLT2抑制剂,该药由默沙东和辉瑞共同开发,于2017年12月获得FDA批准用于2型糖尿病,商品名为Steglatro。
5.先声药业依达拉奉右旋莰醇注射液即将获批。7月24日,先声东元药业1类新药依达拉奉右旋莰醇注射液(依达拉奉复方制剂)上市申请进入“在审批”阶段,有望近期获批,用于治疗缺血性卒中。依达拉奉右莰醇注射液是先声药业依达拉奉注射液(必存)的升级品种。在一项涉及1200例急性缺血性脑卒中患者的III期临床中,与依达拉奉注射液相比,依达拉奉右莰醇注射液显示出明确的疗效优势,临床安全性相似,并大幅度将现有治疗窗从24小时延长到48小时。
6.艾迪药业抗艾滋病新药申报上市。7月25日,艾迪药业抗艾滋病1类新药ACC007片的上市申请获CDE受理。这是艾迪药业递交的首个新药上市申请。ACC007是一款全新一代非核苷类逆转录酶抑制剂,通过非竞争性结合并抑制HIV逆转录酶活性,从而阻止病毒转录和复制。一项已完成的Ⅲ期研究结果显示,ACC007与对照组(依非韦伦)相比达非劣等效性标准;ACC007组患者不良反应发生率方面优于对照组。
国际药讯
1.FDA授权首个COVID-19检测用于筛查无症状人群。LabCorp公司新冠病毒诊断测试LabCorp COVID-19 RT-PCR获FDA授予紧急使用授权(EUA),将该测试扩展到任何人,用于广泛筛查,包括检测没有表现出任何症状以及不曾接触过确诊病例的人员,并允许合并样本测试。此前,这款诊断测试已于3月16日获得FDA授权,但仅适用于处方,用于检测显示早期病毒感染迹象(如发烧)的人群,以及高危人群和一线医护人员。值得一提的是,这是FDA授权针对任何人的首个诊断测试。
2.FDA批准阿斯利康三联COPD新药。阿斯利康布地格福吸入气雾剂Breztri Aerosphere获FDA批准,用于稳定期慢性阻塞性肺病(COPD)患者的维持治疗。Breztri Aerosphere是由布地奈德(ICS)、格隆溴铵(LAMA)和富马酸福莫特罗(LABA)组成的三联吸入制剂,使用Aerosphere递送技术给药。在一项III期ETHOS研究中,Breztri Aerosphere相比二合一吸入制剂Bevespi Aerosphere (LAMA/LABA)、PT009(ICS/LABA)可使COPD急性加重率分别降低24%和13%,均具有统计学意义的显著差异。该新药已于2019年6月和2019年12月分别在日本和中国获批上市,在欧盟的上市申请也正处于审批之中。
3.吉利德JAK1抑制剂获欧盟EMA委员会推荐批准。欧洲药品管理局(EMA)人用医药产品委员会推荐批准吉利德和Galapagos公司联合开发的JAK1抑制剂Jyseleca(filgotinib)上市,用于治疗对一种或多种疾病修饰抗风湿药物反应不足或不耐受的中重度类风湿性关节炎(RA)成人患者。在FINCH和DARWIN试验中,每日一次的filgotinib单药治疗或与MTX联合治疗均显示出一致的安全性特征,所有三项FINCH试验均达到其主要终点。目前,filgotinib的新药申请也在接受FDA的审评,有望今年夏天获得批准。
4.罗氏雷珠单抗玻璃体植入物达III期临床终点。罗氏新型眼内给药系统ranibizumab PDS(雷珠单抗玻璃体植入物),以6个月一次固定间隔填充治疗,在治疗新生血管性(湿性)年龄相关性黄斑变性(nAMD)患者的III期临床ARCHWAY中达非劣效性标准。98.4%的PDS组患者能够每6个月一次补液而无需额外治疗,并且视力改善结果与接受每月一次雷珠单抗注射的患者一致。研究中,患者对PDS植入和再填充的耐受性良好,两个治疗组的安全性结果相当。值得一提的是,PDS是第一个在延长的治疗间隔时间内实现III期阳性结果的nAMD疗法。
5.Sarepta/罗氏基因疗法SRP-900获FDA快速通道资格。罕见病基因疗法公司Sarepta 与罗氏合作开发的基因转移疗法SRP-9001获FDA授予快速通道资格,治疗杜氏肌营养不良症(DMD)。与该公司3款外显子跳过疗法(casimersen、Vyondys 53、Exondys51)仅针对特定基因突变的DMD患者不同,SRP-9001是一种在研基因转移疗法,旨在将编码微营养不良蛋白(micro-dystrophin)的基因传递到肌肉组织,以产生目标蛋白——微营养不良蛋白,是一种针对全部DMD患者的潜在治愈性疗法。
医药热点
1.17家医药企业上榜2020年《财富》中国500强。财富中文网发布2020年《财富》中国500强排行榜,共17家医药类企业上榜。今年500家上榜的中国上市公司总营业收入达到50.5万亿元人民币,较去年增长11%;净利润达到了4.2万亿元,较去年增长超16%。今年上榜公司的年营收门槛接近178亿元,相比去年提升了近10%。医药企业方面,与去年相比,康美药业、嘉事堂药业、科伦药业3家企业跌出榜单,其他企业变化不大,大部分在排名上有所上升。
2.大连疫情已致4省8市79人感染。据辽宁省卫健委通报,7月26日0时至24时,辽宁省新增14例本土新冠肺炎确诊病例,均为大连市报告的无症状感染者转归确诊病例,其中普通型11例、轻型2例、重型1例。新增无症状感染者12例,均为大连市报告病例。据了解,自7月22日辽宁大连确诊此轮疫情首例新冠肺炎病例以来,截至7月26日24时,此次疫情已致4省8市79人感染,其中确诊病例41人,无症状感染者38人。
3.“屠呦呦班”首次招生。中国中医科学院与上海中医药大学联合开设的九年联合培养、本博连读中医学“屠呦呦班”于2020年起开始招生。2020年计划在北京、山东、山西、河南、浙江5个省市招生15人。学生本科阶段由上海中医药大学负责教学培养和管理工作,研究生阶段由中国中医科学院负责。双方组建联合教学团队,共同开展课程开发、课程建设、教材编写、创新创业项目实施等一系列教学改革工作。
股市资讯
【仟源医药】公司产品“磷霉素氨丁三醇散”近日收到国家药监局核签的《药品补充申请批准通知书》,该药品通过一致性评价。
【普门科技】2020年半年度实现营业收入2.59亿元(+26.51%),实现归母净利润6957.19万元(+37.20%),扣非归母净利润5823.37万元(+40.81%)。
【鹭燕医药】公司配股申请获得中国证监会审核通过。
审评动向
1. CDE最新受理情况(07月27日)
2. FDA最新获批情况(北美07月24日)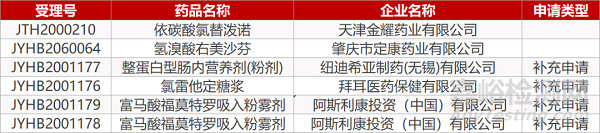
暂无
- The End -

来源:药研发