2020版《中国药典》9099分析方法确认指导原则、9100分析方法转移指导原则明确了分析方法确认及转移的相关要求,但没有细化到操作层面,本人根据《中国药品检验标准操作规范》,结合工作中的实际情况,整理了分析方法转移与确认过程中的关键点,文中的缺陷和不足,望同行批评指正。
1分析方法转移应考虑的关键点
方法转移的目的是证明方法接受实验室能够成功的操作方法,适用范围包括某些进口药品的标准复核,企业内部分析方法由研发部门转移到质控部门;企业位于不同地点的生产工厂之间的方法转移;委托检测等。
1.1、比对性测试应考虑的因素
分析方法转移包含比对性测试,相关测试中考虑的因素包括:被测样品的数量(批次2~5批);被测样品的浓度级别(1~3个浓度);重复测定次数(比如4~6次);被分析物个数(比如1~2个;)分析时间(比如2~5天);来自1个或多个企业的分析仪器(2个实验室都用相同的仪器)。若被测样品有多个规格,那么原则上方法转移应涵盖样品的几个规格(如最高规格和低规格)。如果相同的检验方法被用于样品不同的检验项目,例如含量测定和含量均匀度检查,那么可以只做含量测定方法转移而不需要再额外进行含量均匀度检查方法的转移。另外需要注意的是,如果对照品溶液和供试品溶液的制备略有差别,如提取溶剂的量和容量器具具有规格相应缩放,而其他步骤和操作都是相同的,那么这些分析方法也被认为是相同的而不需要进行方法转移。
1.2、转移方案应考虑的关键点
转移方案应根据被测样品的稳定性、样品的检测结果、方法学验证数据来制定转移方案。方案中应规定样品的选择、检验批数及每次检验所需制备的样品份数以及接受标准。方法转移方案中需要明确以下细节:文件号;转移的目的和范围;转出实验室和接收实验室的名称和信息;样品信息(如剂型、规格、批号、储存条件、运输条件等);被转移的分析方法(名称、标识号、版本号等);测试的批数和每批重复的次数;转移方法所需实验用品和试剂清单(包括标准物质)等;转出实验室提供的文件清单;转移方法所需的设备清单;计划的检验步骤;需要检验的项目和结果评估的标准;报告结果的要求(如结果的修约、小数点位数等);根据转移方法的复杂程度,转移前转出实验室应派1名检验人员到接收实验室进行现场培训。
1.3、分析方法不同转移类型应考虑的关键点
ü 比对相同批次的样品的检测结果,需要检验的样品批数和每批样品需要检验的次数根据被测样品的特性和检验方法的类型来确定,通常以平均值和偏差来评估,确认接收方有能力操作分析方法。
ü 通过共同验证进行方法转移,分析方法在转移前原则上已经过验证。然而可以将分析方法的验证和转移合并在一起来满足1个转出实验室向1个或多个接受实验室进行方法转移的要求。方法重现性实验需评估实验室间的差异(如不同仪器、不同检验人员、不同经验及检验能力)。可以选择1批或多批样品由2个或2个以上实验室的多个检验人员在不同时间进行多次检验。该批样品必须要有代表性,如对于杂质检测来说,该批样品至少包含所有相关的杂质。对于具有不同规格的样品,通常每个规格需要检验1批。如果规格等比例,至少应包括最低规格和最高规格的批次。转移双方应尽量使用相同/等同的检测设备。
ü 通过再验证进行方法转移,在验证的方法学参数根据将要转移的方法的特点和复杂程度来确定。例如,含量均匀度检验主要是方法的准确性和精密度决定的,因此方法接受实验室至少对方法的准确度和精密度做再验证。
ü 通过免除实验进行方法转移,采用该方式一定要有记录并说明原因,如接收实验室已经检验过这个样品或类似样品,并且对检验步骤很熟悉;新剂型与接收实验室以前检验过的剂型有类似的活性组分和含量;分析方法与已在应用的方法类似或相同;接收实验室对别的样品分析方法验证时已包括类似新方法,建立分析方法的检验人员加入了接收实验室;新方法与以前已转移的方法之间只有微小的变更;接收方检验人员与转出方检验人员的技术水平相当;需要转移的方法为通用的检验方法并且接受实验室具有足够的经验。
1.4分析方法转移可接收标准
分析方法转移可接受标准各国药典、指导原则未规定其可接受标准,根据《中国药品检验标准操作规范》相关规定,可接受标准可参照下表
Δ:转出实验室和接收实验室的平均值绝对偏差。
RT:报告阈值(report threshold value).
1:每批样品需要配制的供试品溶液数。
2:中间精密度,如n=4,则是在转移实验室和接收实验室进行的2个重复测定的相对标准偏差。
3:根据USP,EP和JP制定。
分析方法转移报告通常有接收方实验室汇总,内容应包括被测样品的名称;转移的分析方法(名称,版本号);方法转移方案;接受实验室人员的培训记录;责任(如方法转移总结报告的审核和批准);转移中使用的仪器、器具和试剂;转出实验室及接收实验室的检验结果;评估方法转移报告中的偏差及异常结果的调查;根据接收标准评估数据;总结与结论。
2分析方法确认应考虑的关键点
2.1、无需方法确认的检测项目
一般来说,药典中收载的基本检测方法不要求进行方法确认。基本检验方法包括:干燥失重、炽灼残渣、重金属、热分析法等,以及各种湿法化学分析(比如酸值测定)和用简单的仪器进行的检测(如pH测定)等。
2.2、方法确认项应考虑的关键点
在参考欧洲OMCL的《分析方法验证》、AOAC的《如何达到ISO 17025对方法确认的要求》以及《美国药典》附录<1226>的基础之上,并结合药品研发实际工作内容,方法确认的项目分为三类
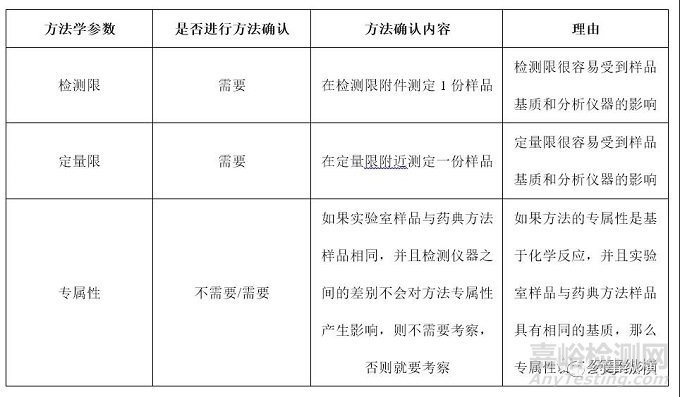
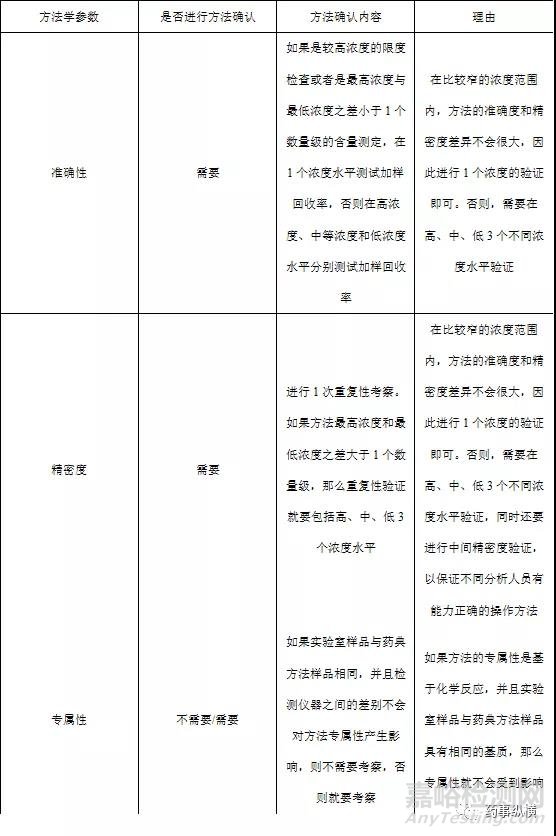
鉴别检查 鉴别检查是药典分析方法中最常见的一个检验项目。由于鉴别检查的目的是为了判断被检测物是否是目标检测物,因此,对于鉴别检查来说最重要的一个方法学参数就是专属性。
被测物浓度在定量限附近的检测检查 对于药典方法中收载限度检查来说,有一部分限度检查是被测物浓度在定量限附近的检测,此类检测最为常用的一类就是残留溶剂检查法。
较高浓度的限度检查和含量测定药典中收载品种的各论项下的有关物质检查很多都是被测物浓度较高的限度检查,另外还有水分测定、2-乙基己酸测定等很多特定检测项目都属于此类检验。由于被测物浓度相对较高,从方法学确认的角度来说,此类检验与含量测定属于同一个类别。
实验室和方法确认的有关文件应该包括:确认计划、被确认方法的详细描述、需要进行确认的方法学参数的详细描述确认结果的判定标准、对偏差的合理解释。
参考文献
[1] 2019年版中国药品检验标准操作规范
[2].Guidance forindustry:analytical proceduires and methods validation:chemistry,manufacturing,and control and documentation[EB/OL]
[3] Guidance for industry:bioanalyticalmethod validation[EB/OL]