您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-12-10 09:32
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.布罗舒单抗即将获批上市。协和发酵麒麟株式会社布罗舒单抗( burosumab)上市申请处于“在审批”阶段,有望近期获批,用于治疗成人和6个月及以上儿童X连锁显性遗传低磷性佝偻病(XLH)。布罗舒单抗是一种靶向FGF23的重组人源化单克隆IgG1抗体,位列我国第二批临床急需境外新药目录,目前已获FDA批准用于治疗6个月以上儿童患者和成人的XLH,以及用于治疗肿瘤性骨软化症。
2.恒瑞「去氧肾上腺素酮咯酸溶液」申报上市。恒瑞3类仿制药「去氧肾上腺素酮咯酸溶液」上市申请获CDE受理,用于白内障手术或人工晶状体置换手术过程中维持瞳孔大小,防止手术中瞳孔缩小并且缓解术后眼部疼痛。去氧肾上腺素酮铬酸溶液是一种复方眼部溶液,由去氧肾上腺素和酮铬酸组成。该药最早由Omeros公司开发,于2014年5月获FDA批准上市,商品名为 Omidria。恒瑞为该品种国内首个申报上市的厂家。
3.凌腾医药卡妥索胃癌全球III期临床进展。凌腾医药宣布其卡妥索双抗(Catumaxomab)完成胃癌全球Ⅲ期临床第一阶段台湾地区首例患者给药,并于近期在韩国开展临床试验受试者入组。III期试验旨在评估卡妥索双抗腹腔灌注在不适合全身性化疗的伴腹膜转移性胃癌患者中的安全与疗效。在欧盟,卡妥索双抗已于2009年获批用于治疗恶性腹水,卡妥索双抗也是全球首个上市的T细胞衔接双抗药物。目前,卡妥索双抗原有适应症于EMA重新审批中。
4.强生Amivantamab双抗国内启动III期临床。强生首次在国内登记启动了EGFR/c-Met双抗Amivantamab的III期临床(CTR20202472),联合第三代EGFR抑制剂Lazertinib一线治疗晚期不可切除的非小细胞肺癌(NSCLC)。这是一项国际多中心III期临床,国内目标入组200例患者,主要研究者是上海市胸科医院的陆舜主任。Amivantamab是「突破性疗法」中美双认证的产品,近日强生已向FDA递交了生物制品许可申请。
5.科兴生物新冠疫苗早期试验结果积极。据彭博12月8日消息,印尼国有制药公司PT Bio Farma日前向媒体透露,科兴生物研发的新冠疫苗在早期试验中有效率高达97%。Bio Farma发言人Iwan Setiawan表示,该有效性是基于一个月临床试验的初步数据,最终的有效性将在1月份确定。目前印度尼西亚已收到首批来自中国的120万剂新冠病毒疫苗,预计明年1月初将另外收到180万剂中国疫苗。据悉这批疫苗来自中国科兴。
6.东曜药业ADC药物TAA013公布 I期积极结果。东曜药业在SABCS2020大会上公布其抗体偶联药物(ADC)TAA013治疗既往经过曲妥珠单抗治疗后疾病进展的HER2阳性乳腺癌的I期临床积极结果。TAA013表现出安全耐受性良好,各剂量组均未观察到剂量限制性毒性;推荐剂量3.6m/kg的客观缓解率为10%,疾病控制率达到70%,中位无进展生存期超过5个月。TAA013是一种含有曲妥珠单抗和美坦新衍生物的在研ADC药物,目前已处于III期开发阶段。
国际药讯
1.FDA发布辉瑞/BioNTech新冠疫苗详细评估。FDA在官网公布了内部科学家对辉瑞/BioNTech候选新冠疫苗BNT162b2的紧急使用授权(EUA)申请材料的评估。FDA的科学家表示,BNT162b2具有良好的保护效力和安全性;在防护出现症状的COVID-19方面总体效力达到94.6%,而且保护效力在不同年龄、族裔、以及携带不同风险因子的人群中有着高度的一致性。值得一提的是,BNT162b2在首次疫苗接种后10天左右,就开始显示出保护效力,在接种两针的间隔期,BNT162b2的保护效力达到52.4%。FDA将于12月10日召开疫苗与相关生物制品咨询委员会(VRBPAC)会议,对BNT162b2进行审评。
2.UniQure血友病B基因疗法Ⅲ期临床结果积极。uniQure公司在ASH2020年会上公布了AAV5基因疗法etranacogene dezaparvovec治疗血友病B的关键性Ⅲ期临床HOPE-B最新数据。治疗26周后,这一疗法将患者体内FIX活性水平从基线的2%以下提高到37.2%,达到研究的第一个主要终点;将患者需要治疗的出血次数减少了91%;所有患者的FIX替代治疗使用率下降了96%,54例患者中的52例(98%)成功停止了预防性输注。该公司计划明年下半年向FDA和EMA递交监管申请。
3.新一代广谱激酶抑制剂获FDA突破性疗法认定。FDA授予Turning Point公司新一代广谱性激酶抑制剂Repotrectinib突破性疗法认定,用于治疗ROS1酪氨酸激酶抑制剂(TKI-naïve)初治的ROS1阳性转移性非小细胞肺癌(NSCLC)患者。该突破性疗法的认定得到了TRIDENT-1研究I期和II期纳入的TKI-naïve ROS1阳性NSCLC患者初始数据的支持,该研究目前正在对多个潜在登记队列的患者进行评估。该公司计划在明年的世界肺癌大会上更新TRIDENT-1研究II期研究数据。repotrectinib此前已获FDA授予的三个快速通道许可。
4.辉瑞BCMA/CD3双抗治疗多发性骨髓瘤I期数据积极。辉瑞制药公布BCMA/CD3双特异性抗体PF-06863135治疗复发/难治性多发性骨髓瘤(MM)的I期临床(NCT03269136)积极数据。来自30例复发/难治性MM患者数据显示,皮下注射PF-06863135所有剂量安全性可控,未观察到剂量限制性毒性反应;有效剂量在每周215~1000μg/kg的20例患者总缓解率(ORR)为80%;最高剂量组ORR为83%(5/6例)。辉瑞将选定每周1,000μg/kg作为II期临床推荐剂量。
5.强生与Xencor达成CD28双抗开发合作。Xencor与强生达成一项全球独家许可协议。Xencor将使用其XmAb双特异性Fc技术平台构建杨森公司(强生旗下公司)指定靶向肿瘤CD28的双特异性抗体,用于开发前列腺癌的潜在治疗药物。根据协议,Xencor将获得强生5000万美元的预付款和开发、监管、销售里程碑付款,以及产品的销售分成。强生将拥有候选药物临床前研究、临床开发、监管及商业化活动全生命周期的全球独家许可权利。
医药热点
1.重庆“互联网+”医疗明年入医保。重庆市印发《关于公布重庆市第一批“互联网+”医疗服务项目价格和医保支付政策的通知》,从明年1月1日起,重庆市首批“互联网+”医疗服务价格项目将全部纳入医保报销。首批“互联网+”医疗服务项目有互联网复诊、远程会诊、远程监测3个类别共9个项目,即互联网复诊、远程单学科会诊、远程多学科会诊、同步远程病理会诊、非同步远程病理会诊、远程心电监测、远程起搏器监测、远程除颤器监测、远程胎心监测。
2.北京医防融合培训与评职称挂钩。北京市印发《北京市医防融合培训方案(2020年-2022年)》,计划到2022年,打造一支600人以上、具备公卫应急、院前急救等多重能力的复合型人才队伍。医防融合培训的对象主要为二级、三级医疗机构拟晋升副高级职称的内科类医师、急救中心拟晋升副高级职称的临床医师和疾病预防控制中心拟晋升副高级职称的公共卫生医师。从2021年起,完成医防融合培训的人员优先推荐晋升,自2023年起作为晋升的必备条件之一。其他医师也可自愿参加培训,完成培训的,在晋升副高职称前优先推荐。
3.第四批国采涉及90个品规。第四批国家药品集采传来最新消息,12月9日在北京召开了集采座谈会,会议确定了第四批国采名单并要求各省开始进行报量。第四批集采名单共计90个品规,以口服常释剂型为主,注射剂有8款,分别为氨溴索注射剂、丙泊酚中长链脂肪乳、布洛芬注射液、多索茶碱注射剂、帕瑞昔布注射剂、泮托拉唑注射剂、硼替佐米注射剂和注射用比伐芦定。此外,本次涉及一款吸入剂,吸入用硫酸沙丁胺醇溶液。还涉及 2 款眼用制剂,分别为盐酸奥洛他定滴眼液、透明质酸滴眼剂(玻璃酸钠)。
股市资讯
【人福医药】(1)控股子公司九珑人福收到米非司酮片的《药品补充申请批准通知书》。(2)全资子公司人福新加坡以2亿美元转让乐斯福集团40%股权。
【白云山】公司分公司白云山制药总厂收到关于头孢安苄胶囊的《药品补充申请批准通知书》,通过仿制药一致性评价。
【仙琚制药】公司收到关于罗库溴铵的《药品补充申请批准通知书》通过仿制药一致性评价。
审评动向
2. FDA最新获批情况(北美12月08日)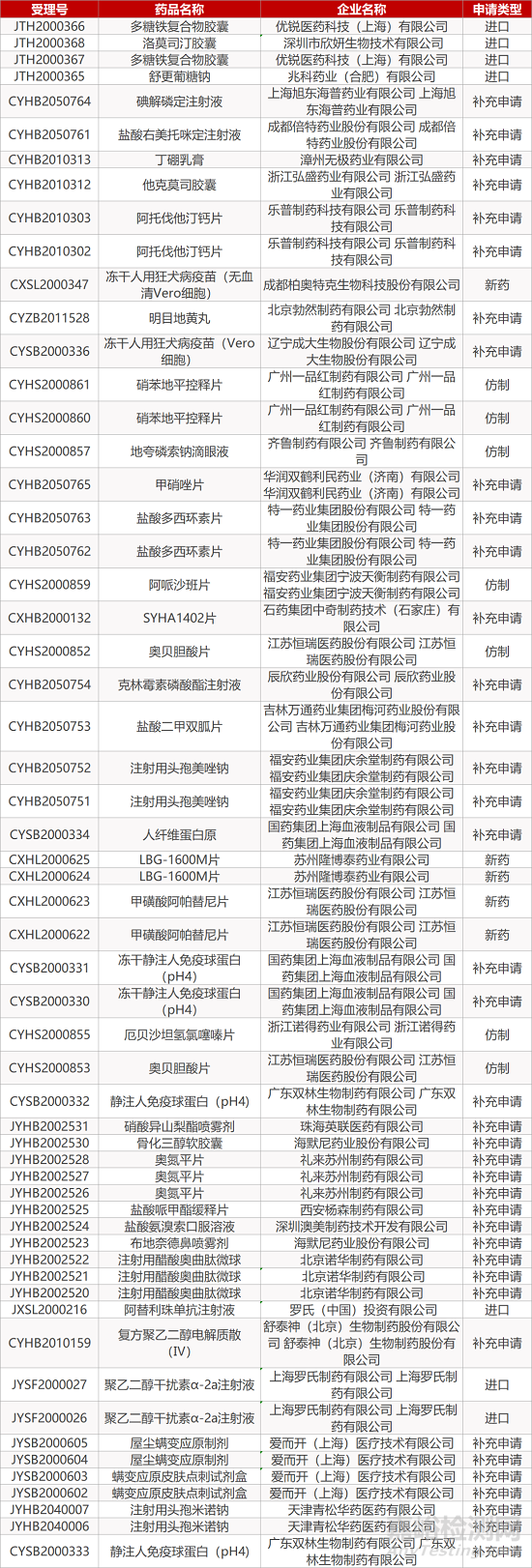

- The End -

来源:药研发