您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-12-29 11:14
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.信达贝伐珠单抗获批第三个适应症。信达生物重组抗VEGF人源化单克隆抗体药物达攸同(贝伐珠单抗生物类似药)获NMPA批准,用于治疗成人复发性胶质母细胞瘤(GBM)。这是继今年6月首次获批用于治疗晚期非小细胞肺癌和转移性结直肠癌后,达攸同获批的第3个适应症。贝伐珠单抗原研产品为罗氏旗下安维汀,目前该产品已在全球范围内获批治疗转移性结直肠癌、乳腺癌、肾癌、宫颈癌等多种癌症,是全球十大畅销药物之一。
2.天士力米诺膦酸片即将获批上市。天士力帝益药业米诺膦酸片3类仿制上市申请审评状态变更为“在审批”,近期即将获批,有望成为该品种首个仿制药。米诺膦酸是一种双膦酸盐类骨质疏松症治疗药物,属于第三代双膦酸盐类药物,目前国内市场暂无原研及国产仿制上市。米内网数据显示,在中国公立医疗机构终端肌肉骨骼系统市场中,治疗骨骼疾病的药物为第二大亚类,2018年的销售规模突破百亿。
3.苏庇医药依帕伐单抗拟纳入优先审评。苏庇医药合作品种依帕伐单抗注射液(emapalumab)三项上市申请获CDE拟纳入优先审评,申请适应症为:用于难治性、复发性或进展性疾病或对常规HLH疗法不耐受的原发性噬血细胞性淋巴组织细胞增多症(HLH)成人和儿童(新生儿及以上)患者的治疗。依帕伐单抗是一款IFNγ靶向单抗,已于2018年在美国获批上市,是FDA批准的首款针对HLH的抗体疗法。
4.恒瑞SHR-1819注射液获批临床。上海恒瑞SHR-1819注射液获国家药监局临床试验默示许可,即将开展用于哮喘的临床试验。SHR-1819注射液可以阻断白介素通路,抑制下游炎性信号的传导,最终改善疾病的炎症状态并控制疾病进展。目前已有同靶点药物在国内外获批上市,并且有多个公司的同类产品在临床开发阶段,适应症以炎症性疾病为主。EvaluatePharma数据库显示,同靶点药物2019年全球销售额约为23.22亿美元。
5.阿斯利康TSLP抑制剂中国获批临床。阿斯利康TSLP抑制剂tezepelumab注射液获国家药监局临床试验默示许可,拟开发用于治疗重度慢性鼻窦炎伴鼻息肉。TSLP是一种上皮细胞因子,它是包括哮喘在内的各种疾病中多种炎症途径的上游调节子,对气道炎症的发生和持续进行至关重要。研究显示,TSLP在调节T2免疫中很活跃。同时,它也可以通过向多种类型的细胞(如肥大细胞,嗜碱性粒细胞)激活或发出信号,从而在非T2驱动的炎症中发挥作用。
国际药讯
1.Zogenix芬氟拉明口服液在欧盟获批。欧盟委员会(EC)批准Zogenix公司低剂量芬氟拉明口服溶液Fintepla上市,作为其他抗癫痫药物的附加疗法,用于治疗两岁及以上患者Dravet综合征相关癫痫发作。此次批准是基于两项Ⅲ期临床研究以及一项长期、开放标签扩展试验的积极结果。与其他抗癫痫疗法(包括司替戊醇)联合使用时,Fintepla可显著降低患者每月癫痫发作的频率。在美国,Fintepla用于上述适应症已获FDA批准。
2.新型靶向免疫毒素Vicineum完成美国滚动上市申请。Sesen Bio公司宣布已向FDA提交了新型抗体药物偶联物Vicineum(oportuzumab monatox,VB4-845)用于治疗高风险的、对卡介苗(BCG)无应答的非肌层浸润性膀胱癌(NMIBC)的一份完整的生物制品许可申请,并申请授予其优先审查资格。Vicineum已于2005年在美国和欧盟获授予孤儿药资格,于2018年8月获FDA授予快速通道资格,用于治疗对BCG免疫疗法无效的NMIBC。预估该新药将于明年年中获得上市批准。
3.Verrica传染性软疣治疗药物VP-102申报美国上市。Verrica Pharmaceutical公司宣布已重新向FDA提交了VP-102(cantharidin,斑蝥素,0.7%w/v,外用溶液)的新药申请(NDA)。VP-102是一种专有的药物-设备组合产品,通过外用涂抹给药,用于治疗传染性软疣。VP-102 NDA的重新提交是根据与FDA举行的A类会议结果,该会议旨在澄清FDA于2020年7月发布的完整回应函(CRL)。如果获批,VP-102将成为美国市场首个治疗传染性软疣的药物,并以商品名Ycanth销售。
4.Rubraca治疗BRCA突变卵巢癌达Ⅲ期终点。Clovis Oncology制药公司PARP靶向抗癌药Rubraca(rucaparib)治疗复发性BRCA突变卵巢癌的Ⅲ期ARIEL4研究获顶线结果。在疗效人群中,与化疗组相比,Rubraca组患者的无进展生存期显著改善(中位PFS:7.4个月vs5.4个月;HR=0.639;p=0.0010);在ITT人群中,与化疗组相比,Rubraca组患者的无进展生存期也具有统计学意义的显著改善(中位PFS:7.4个月vs5.7个月;HR=0.665;p=0.0017);而且Rubraca的安全性与美国和欧盟的标签高度一致。
5.Aerovate 伊马替尼获FDA孤儿药资格。FDA授予Aerovate Therapeutics伊马替尼吸入干粉制剂(imatinib,AV-101)孤儿药资格,用于治疗肺动脉高压(PAH)。伊马替尼是一种酪氨酸激酶小分子抑制剂,能够抑制BCR-ABL,PDGFR以及c-KIT蛋白激酶的活性。这些蛋白激酶介导的信号通路被认为与肺动脉高压的疾病进展相关。伊马替尼吸入干粉制剂可将药物直接递送至病变肺组织,具有减少全身不良反应的潜力。
6.罕见炎症性疾病抗体药物CERC-007在美申报临床。Cerecor公司IL-18单抗CERC-007治疗斯蒂尔病的新药临床试验(IND)申请获FDA受理。Cerecor公司计划在2021年第一季度启动CERC-007治疗成人斯蒂尔病(AOSD)的全球多中心Ⅰb期临床试验,旨在确定CERC-007的安全性和耐受性,并通过患者全身临床表现和炎症标志物的改善程度,评估该疗法的初步疗效。研究计划入组约12例活动性AOSD患者,预计可在明年第二季度获得初始数据。
医药热点
1.欧狄沃患者年自付比例最高降幅超75%。中国癌症基金会宣布,“欧狄沃患者援助项目”援助方案将再次更新,方案由原来的“首次3+3,后续3+4循环”调整为年度“3+3,后续3+X”,即符合项目标准的患者,在申请年度内最多自付6次欧狄沃的治疗费用,便可获得该申请年度内剩余的所有药品援助,患者可按申请年度重复发起援助申请,直至项目终止或疾病进展。在新方案下,患者年自付比例较上市价格最高降幅超75%。
2.抗肿瘤药物临床应用情况纳入医疗机构考核评价。12月24日,国家卫健委发布了《关于印发抗肿瘤药物临床应用管理办法(试行)》,其中规定,原则上,在病理确诊结果出具前,医师不得开具抗肿瘤药物进行治疗。《管理办法》明确,要求各级卫健行政部门将抗肿瘤药物临床应用情况纳入对医疗机构的考核评价;要求医疗机构将其纳入医师定期考核、临床科室和医务人员业务考核,并对取消和限制医师处方权的情形作出规定。
3.变异新冠病毒在日本首次出现人传人。据日本共同社报道,26日,一位曾前往英国的30多岁男性及其家人确诊感染变异新冠病毒。该名男子为飞行员,不属于机场检疫对象,机场并未对其进行检查。而这位确诊的女性家人未曾前往英国,日本厚生劳动省认为她是在国内被该名男子传染。报道称,这种变异新冠病毒在日本国内出现人传人尚属首次。25日,日本宣布在入境检疫中首次发现5人感染近期英国报告的变异新冠病毒。
股市资讯
【中国生物制药】公司的肌松药苯磺顺阿曲库铵注射液(商品名:得泰安)获药品注册证书,且视同通过一致性评价,为国内首批。
【人福医药】子公司武汉人福安立生坦片获得药品注册批件。
【苑东生物】公司的硫酸氢氯吡格雷片获得《药品注册证书》。
审评动向
1. CDE最新受理情况(12月28日)
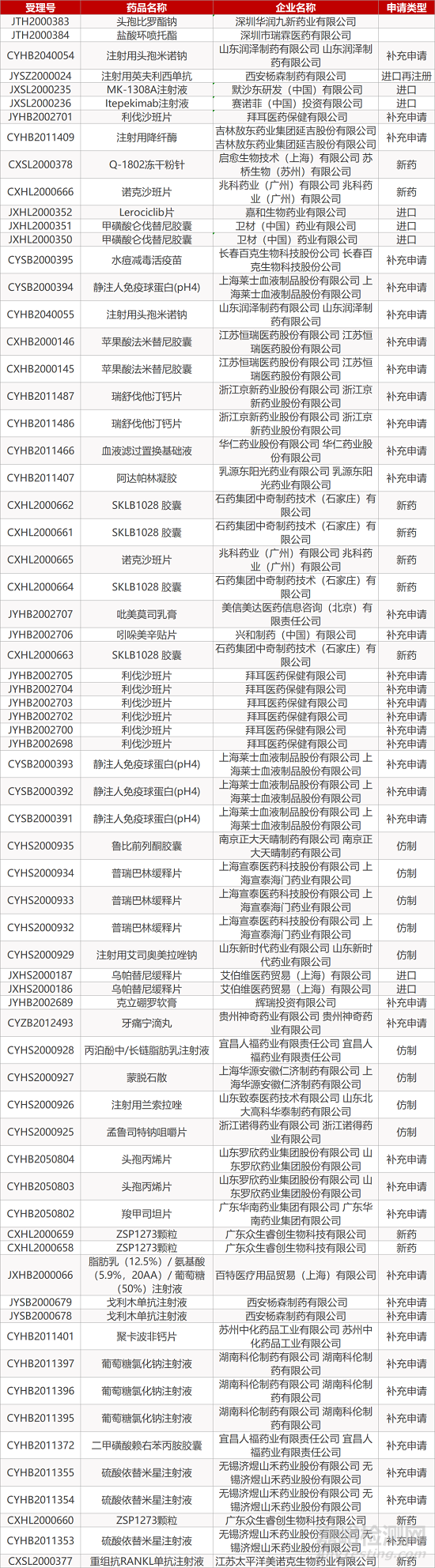
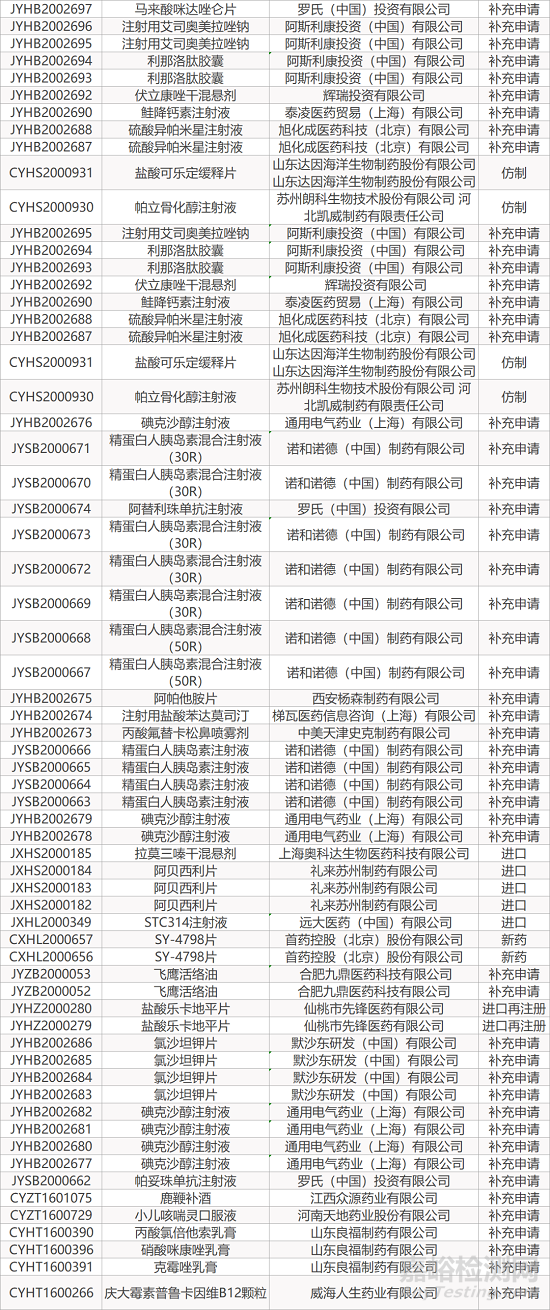
暂无
- The End -

来源:药研发