您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-12-30 11:12
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
诺华眼科新药在华获批上市。诺华宣布其眼科新药Pataday(通用名:0.2%盐酸奥洛他定滴眼液)获国家药监局批准上市,用于治疗过敏性结膜炎相关的眼痒。Pataday是升级版盐酸奥洛他定滴眼液。它将盐酸奥洛他定的浓度提升到了0.2%,不仅继续保持双效抗敏的作用机制,还将使用频率降低,一天一次,即可24小时持久有效,为过敏性结膜炎患者带来了更方便的治疗新选择。
国内药讯
1.和黄启动向FDA滚动提交索凡替尼上市申请。和黄医药向FDA滚动提交了索凡替尼用于治疗胰腺和非胰腺神经内分泌瘤(NETs)的新药上市申请(NDA),完整的上市申请预计于明年上半年完成。索凡替尼(surufatinib)是一款新型的口服酪氨酸激酶抑制剂,FDA已授予其用于治疗胰腺神经内分泌瘤的孤儿药资格;以及用于治疗胰腺和非胰腺神经内分泌瘤的两项快速通道资格。在中国,该新药相同适应症上市申请已获CDE受理,其中,治疗非胰腺神经内分泌瘤的NDA已被纳入优先审评。
2.正大天晴鲁比前列酮胶囊首家申报上市。正大天晴鲁比前列酮胶囊3类仿制上市申请获CDE受理。鲁比前列酮是一款局限性氯离子通道激活剂,是FDA批准上市的首个化学类便秘治疗药物,武田制药于2014年斥资不超过4900万美元获得鲁比前列酮全球开发和使用权(除日本及中国市场),2019年全球销售额为281亿日元。目前国内暂无鲁比前列酮相关制剂获批上市,正大天晴为首家申报上市的药企。
3.恒瑞IL-2衍生物申报临床。恒瑞医药1类新药注射用SHR-1916的临床试验申请获CDE受理,拟用于晚期恶性肿瘤的治疗。SHR-1916是国内首个申报临床的国产IL-2衍生物治疗药物,可以通过激活JAK1/JAK3/STAT5信号通路,促进CD8+T和NK细胞增殖,发挥抗肿瘤作用。与IL-2本身相比,SHR-1916对调节性T细胞的激活降低、对免疫效应细胞的激活不受影响或增高。除恒瑞医药之外,目前国内的信达生物和君实生物也布局了IL-2衍生物治疗领域。
4.阿诺医药与罗氏拟开展联合用药临床研究。阿诺医药PI3K抑制剂AN2025、EP4拮抗剂AN0025拟联合罗氏制药PD-L1阿替利珠单抗开展联合用药的I期临床试验。该项研究将评估AN2025和AN0025在局部晚期/转移性实体瘤患者中与阿替利珠单抗联用的安全性、耐受性、药代动力学以及联合用药的初步疗效,并根据剂量限制毒性(DLT)确定与阿替利珠单抗同时给药时的合适剂量。罗氏将为该临床试验提供阿替利珠单抗。
5.再鼎医药和Cullinan公司达成独家授权合作。再鼎医药与Cullinan Oncology公司就Cullinan的口服EGFR抑制剂CLN-081达成独家许可协议。CLN-081目前正在一项Ⅰ/Ⅱa期剂量递增和扩展研究中评估用于治疗EGFR Ex20ins突变非小细胞肺癌患者的潜力。根据协议,再鼎医药将获得在大中华区独家开发、制造和商业化CLN-081的权利;Cullinan Oncology旗下子公司Cullinan Pearl将获得2,000万美元的预付款,可能最高至2.11亿美元的里程碑付款以及产品的销售分成。
国际药讯
1.利普卓日本获批3项适应症。阿斯利康与默沙东联合开发的靶向抗癌药Lynparza(利普卓,olaparib)在日本获批3个适应症:联合贝伐单抗一线维持治疗接受一线化疗后病情缓解的同源重组缺陷(HRD)阳性晚期卵巢癌成人患者;治疗有远端转移、携带BRCA基因突变(BRCAm)的去势抵抗性前列腺癌(mCRPC)患者;用于一线维持治疗接受一线化疗后病情无进展的不可切除性BRCAm胰腺癌患者。Lynparza是日本唯一一个被批准治疗mCRPC和胰腺癌的PARP抑制剂。
2.Cara突破性血透相关瘙痒疗法在美申报上市。Cara Therapeutics公司宣布已向FDA提交了Korsuva(difelikefalin)注射液用于治疗血液透析患者相关重度瘙痒的新药申请,并申请授予其优先审评资格。Korsuva是一款选择性KORs小分子抑制剂,此前已获FDA授予的突破性疗法认定。在一项Ⅲ期临床KALM-2中,与安慰剂组相比,Korsuva治疗组第12周的每日24小时瘙痒强度数字评定量表(WI-NRS)评分降低3分或以上的患者比例显著提高(54%vs42%),达主要终点指标。
3.BMS口服S1P受体调节剂Zeposia欧盟申请新适应症。欧洲药品管理局受理百时美施贵宝口服S1P受体调节剂Zeposia(ozanimod)的新营销授权申请,用于治疗中重度溃疡性结肠炎(UC)患者。在一项关键Ⅲ期临床TRUE NORTH研究(NCT02435992)中,与安慰剂相比,Zeposia在诱导期第10周诱导的临床缓解结果、在维持期第52周维持临床缓解的结果具有统计学意义的显著改善;Zeposia在UC患者中的总体安全性与已获批的复发-缓解型多发性硬化症标签中的已知安全性信息一致。
4.杨森EGFR-MET双抗amivantamab欧盟申报上市。杨森向欧洲药品管理局提交了EGFR-MET双抗amivantamab(JNJ-61186372,JNJ-6372)的营销授权申请(MAA),用于治疗含铂化疗后疾病进展、携带EGFR外显子20插入突变的转移性非小细胞肺癌(NSCLC)患者。本月初,该新药也向FDA提交了相同适应症的上市申请。如果获批,amivantamab将成为这类NSCLC患者的首款疗法。在一项I期CHRYSALIS研究(NCT02609776)中,amivantamab在可评估患者中的ORR为36%(95%CI:21-53);在先前接受含铂化疗的患者中的ORR为41%。
5.第一三共Tarlig治疗中枢神经病理性疼痛结果积极。第一三共(Daiichi Sankyo)α2δ配体药物Tarlige(mirogabalin)治疗脊髓损伤(SCI)后中枢神经病理性疼痛(CNP)的Ⅲ期研究达到主要终点。与安慰剂相比,mirogabalin显著改善了患者从基线检查至服药治疗第14周的平均每日疼痛评分,临床中没有观察到额外的安全问题。详细结果将在学术会议和出版物上发表。2019年1月,Tarlige已在日本获批用于治疗周围神经病理性疼痛(PNP)。
6.辉瑞联手Myovant Sciences开发GnRH受体拮抗剂。Myovant Sciences与辉瑞就Myovant的一款 GnRH受体拮抗剂relugolix达成合作许可协议。relugolix已在本月获FDA批准,用于治疗晚期前列腺癌;relugolix复方片剂(relugolix 40 mg、雌二醇1.0 mg和醋酸炔诺酮0.5 mg)已向FDA提交了治疗子宫肌瘤的新药申请。根据协议,两家公司将在美国和加拿大共同开发和商业化relugolix复方片剂,用于治疗肿瘤学和女性健康领域疾病;Myovant将领导relugolix复方片剂的临床开发,负责监管互动和药物供应;Myovant将获得高达42亿美元付款,包括6.5亿美元的前期付款。
医药热点
1.东北亚中医药研究院成立。26日,东北亚中医药研究院在长春中医药大学成立,中国科学院院士仝小林担任该院的首任院长。东北亚中医药研究院分设中医研究所、中药研究所、针灸推拿研究所、基础研究所、交叉前沿研究所等5个研究所,主要围绕代谢性疾病等中医优势病种、重大突发传染性疾病、中医治未病与康复、长白山道地中药材资源开发利用及中医药智能装备研发等几个方面开展创新研究。
2.新版三级医院评审标准发布。28日,国家卫健委印发《三级医院评审标准(2020年版)》,这也是九年来首次对三级医院评审标准的大修。新版标准要求,医疗服务能力与质量安全日常监测数据部分在评审综合得分中的权重不低于60%,包括新增加的医院资源配置、质量、安全、服务、绩效等指标监测以及DRG评价、单病种质控和重点医疗技术等日常监测数据。
3.海南开建公卫临床中心。12月28日,海南省公共卫生中心项目开工建设。项目包括海南省疾控中心异地新建和海南省公卫临床中心两个项目,总投资13.08亿元,建设工期2年。作为海南省疾控工作技术管理与应用研究指导中心,该项目建成后,将改善海南疾控工作条件,补齐公卫应急体系建设的短板。“十三五”期间,为提高各级疾控中心实验室设备配置水平和检测能力,海南省已有8个基层疾控中心启动新址建设或实验室大楼改扩建。
股市资讯
【方盛制药】(1)公司的小儿荆杏止咳颗粒经谈判纳入《国家医保目录》。(2)公司参股子公司夕乐苑拟新增注册资本2,500万元,新增股东星辰康健基金认缴2千万元,夕乐苑现有股东何国才先生认缴500万元;公司及控股子公司湘雅制药放弃本次增资优先认购权;
【江中药业】公司及控股子公司共28个产品纳入《国家医保目录》,其中健胃消食片(限儿童)新调入。
【华东医药】全资子公司中美华东医保谈判成功,百令胶囊的新医保支付标准分别为1.03元(0.5g/粒)及0.51元(0.2g/粒 ),分别比目前全国最低省级医保支付价格降低33%及33.8%;阿卡波糖咀嚼片医保续约后的新医保支付标准为0.465元(50mg/片),比之前的国家医保支付价格降低38%。本次调整于2021年3月1日生效。
审评动向
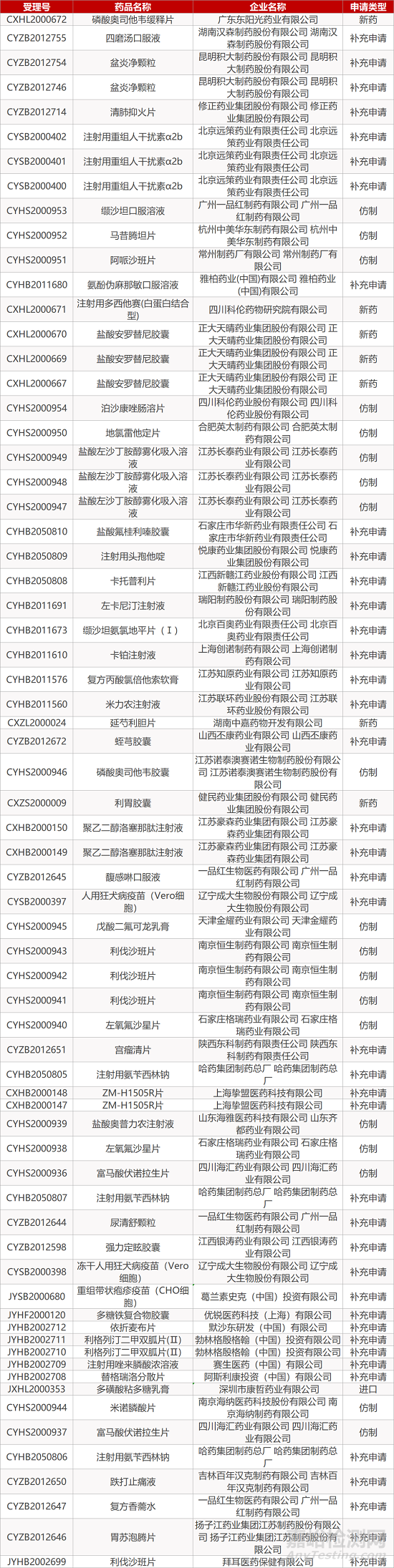
1. CDE最新受理情况(12月29日)
- The End -

来源:药研发


