您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-02-12 09:37
• 第一种模式是试验设计雷同,套用已有的套路,进行小修小补;
• 第二种模式是同一机制,创新设计;
• 第三种模式是新靶点认识,国际同步创新。
近日,在央视的镜头下,上海市胸科医院的陆舜教授再度成为了焦点人物。他的研究成果不仅登上了《新英格兰医学杂志》,更在美国美国临床肿瘤学会(ASCO)主席论坛的演讲中,引起了数千名专家和学者的共鸣。他们集体起立,以掌声向这位中国学者致敬。陆舜教授的临床研究和创新,正一步步将“让肺癌变成慢性病”的愿景变为现实。在去年研发客临床年会暨ChinaTrials16上,他也带来了肺癌领域的全新研究和当下国内创新研发的思考。
在2020年至2022年间,陆舜引领了不少重要的肺癌新药3期临床试验。目前,他和团队开展了22项肺癌适应症的临床试验,13项是国家1.1类新药的研究,9项是跨国公司在中国开展的MRCT。
从一名临床大夫的视角来看,陆舜认为,中国肺癌的形势依然严峻。根据国家癌症中心发布的数据,2023年中国肺癌的新发病例约为82.8万,占全部新发癌症病例比例约为30%,占所有癌症死亡的37.4%。陆舜表示:“肺癌的高发病率和高死亡率,迫使我们不得不加快新药研发的步伐。”
肺癌治疗临床研究速度加快
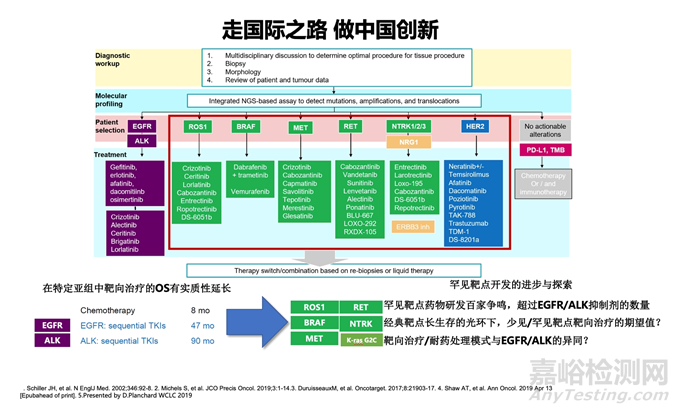
回到国内肺癌药物研发现状,陆舜说取得的进展有目共睹,尤其是疫情之前,美国在肺癌治疗领域拥有7个靶点的靶向药物,而我国仅有EGFR、ALK、ROS1这3个靶点。不过,自疫情以来,中国在肺癌治疗领域的靶向药研发上取得了进展,与美国的差距已缩小至仅0.5个靶点,且这0.5个靶点的新药已提交NDA。
来源|陆舜教授PPT
为了进一步推动鼓励创新,国家药监局将创新药临床试验审评审批时限由60个工作日缩短至30个工作日,并在北京和上海各10家机构进行了试点,首批优化了创新临床机构。
而陆舜所在的上海市胸科医院,成为首批新药临床试验默示许可时限缩短试点机构之一。“这项政策使得我们能更快地进入临床试验阶段,为患者提供更早参加试验的机会。”
此外,上海申康启动了肿瘤数据库,上海市胸科医院还牵头上海市八家医院,共同承担“促进市级医院临床技能与临床创新三年行动计划”,建设上海市肺癌数据库与生物样本全息库一体化平台。该平台不仅支持治疗过程中数据质控、汇交、统计和分析,还整合临床资料数据与基础研究的多组学数据,包括基因组学、肠道宏基因组学、代谢组学和免疫组学等。利用丰富的组学数据,他们开展了一系列基础和转化研究,为临床研究提供了基本保障。特别是对于罕见突变的研究,必须依靠数据库来寻找相关患者。该数据库最近已上线并可商业化运营,这得益于国家的政策鼓励,为肺癌等肿瘤疾病的研究提供了数据资源。
试验设计的三种模式与创新实践
陆舜将中国的临床试验设计分为三种模式。
第一种模式是试验设计雷同,套用已有的套路,进行小修小补。例如,他曾负责了中国第一个、全球第二个三代EGFR抑制剂的临床试验,这个试验方案参考了奥希替尼的设计思路。然而,他并不满足于简单的模仿,而是在此基础上进行了优化。
以阿美替尼的1/2期、开放、多中心研究为例。试验是为了评估每日一次口服该药对既往接受过表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)治疗后疾病进展的局部晚期或转移性NSCLC患者的安全性、耐受性、药代动力学和有效性。为了准确评估选定剂量,试验分为1期递增和扩展阶段,以确定安全剂量范围并评估药代动力学特性,随后在2期延伸阶段进一步确认在T790M突变患者中的疗效,为阿美替尼的临床应用提供了科学依据。
阿美替尼的2期试验结果显示,患者中位PFS为12.3个月,中位DOR为12.4个月。脑转移患者中位mPFS为10.8个月,中位mDOR为11.3个月。这些数据表明,阿美替尼在EGFR-TKI耐药患者中具有一定疗效。此外,阿美替尼一线治疗EGFR突变阳性晚期NSCLC的3期临床研究中,阿美替尼组的中位无进展生存期(mPFS)达到了19.3个月,相较于吉非替尼组的9.9个月,具有显著的生存获益。

来源|陆舜教授的PPT
“EGFR突变在非小细胞肺癌患者中占比高达1/3,每年新增病患约23.4万人,治疗需求巨大。针对中国肺癌患者高频驱动的EGFR基因突变,研究人员要不断优化靶向治疗方案的研究与成果。中国领衔了全球第二的肺癌第三代EGFR靶向药临床研究,并获批上市,提高了患者的长期生存率,从化疗时代的10个月提升至50个月。这一方案受到了国际同行的认可,解决了用药的可及性问题。”陆舜说。
第二种模式是同一机制,创新设计。陆舜展示了全球首创的肺癌免疫治疗新模式,特别是针对晚期肺癌患者中EGFR-TKI耐药人群的治疗方案。
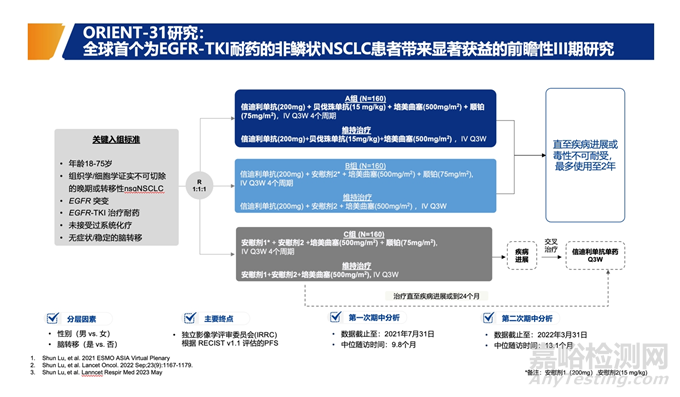
例如,Orient-31是一项全球前瞻性的3期临床试验,以评估信迪利单抗联合不同治疗方案对EGFR-TKI耐药的非鳞状非小细胞肺癌(NSCLC)患者的疗效,有利于免疫检查点抑制剂的使用。
结果显示,信迪利单抗联合贝伐珠单抗及化疗可以延长PFS达7.2个月,并显著降低疾病进展风险达49%。陆舜说:“这一结果为EGFR-TKI治疗失败的NSCLC患者提供了新的治疗选择。”
陆舜还介绍了其团队在围术期免疫治疗领域以及新靶点探索方面的创新研究成果。例如,NEOTORCH研究揭示了特瑞普利单抗联合化疗在可切除肺癌患者中的疗效。这项研究标志着国产PD-1抑制剂在围手术期应用的首个适应症探索取得了重要突破,走在了国际前沿。
来源|陆舜教授的PPT
第三种模式是新靶点认识,国际同步创新。他展示了MET基因变异导致c-MET蛋白无法正常降解、过度激活或过度表达,使MET通路异常激活的多种形式。这些变异形式在NSCLC的治疗中成为了新靶点,而国内外靶向治疗也相继获批。“理解这些新靶点对开发创新疗法和实现国际同步创新具有重要意义。”
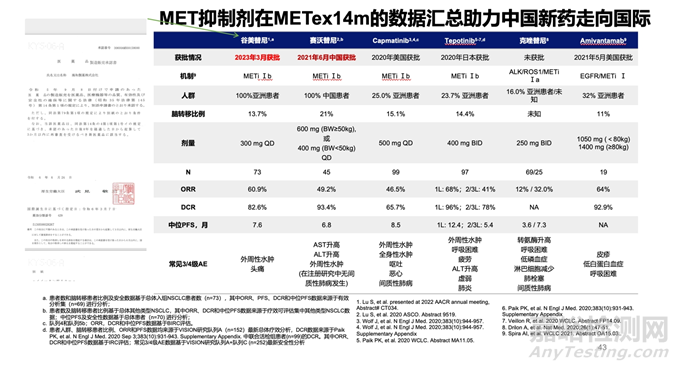
他回顾了2012年赛沃替尼在晚期实体瘤患者中的1期临床研究启动。这项研究首次在澳大利亚开展,汇集了来自多个剂量递增和扩展队列的数据。研究结果显示,赛沃替尼作为强效和选择性MET抑制剂,具有良好的安全性和耐受性。随后,赛沃替尼针对治疗靶点与适用人群进行了广泛的研究。
来源|陆舜教授的PPT
目前,赛沃替尼和谷美替尼在2021年和2023年发表在重要医学期刊上,并在2023年的世界肺癌大会(WCLC)和2021年的美国癌症研究协会年会(AACR)上进行了报告。谷美替尼和赛沃替尼在中国已获批,并在亚洲患者中显示出较高的有效性和安全性。
对于未来的试验设计,陆舜表示,他不会完全抄袭国际上的方案,而是会结合中国患者的实际需求,进行创新和调整。“我们的试验设计是基于对中国患者的了解。我们相信,只有结合实际情况进行创新,才能取得更好的治疗效果。”
对科学深入理解与药物研发策略
陆舜特别强调了科学研究的重要性。他说,对科学的深入理解远比钻空子要重要得多。以K药(Keytruda)为例,其成功并非来自3期临床试验,而是源于对1期临床试验数据的科学判断。“在药物研发过程中,对科学原理的深入理解和精准把握至关重要。我们不能仅仅依靠模仿和套用,而要有自己的思考和判断。”
在谈到药物研发科学的理解时,他认为,他们很少见到药物在剂量爬坡阶段就同时进行扩展的情况。例如,第一代TKI在开展研究时,罗氏和阿斯利康采取了不同的战略。罗氏对于Tarceva(厄洛替尼)采用了经典的化疗药物开发策略,而阿斯利康的吉非替尼则提出了靶向治疗中的所谓“最佳生物剂量”概念。这一经历让陆舜认识到在靶向治疗中,生物有效剂量的重要性。
在阿美替尼的研发过程中,陆舜及其团队也遇到了类似的挑战。在进行奥希替尼与阿美替尼头对头临床试验时,他们采取了剂量爬坡与扩展同时进行的策略。然而,扩展组的结果却大出所料。55毫克的缓解率竟高于110毫克,而PFS则旗鼓相当。最终,他们决定选择110毫克作为阿美替尼的推荐剂量,并得到了与国家药监局当初同意的单臂审评结果相一致的数据。
陆舜认为,找到靶点并开发相应适应症是药物研发的关键。对于罕见靶点,可以通过单臂审评来获得批准。在中国肺癌的9个靶点领域,上海市胸科医院都有适应症开发的经验,其中部分已经获批上市,极大地解决了中国病人的药物可及性问题。
“1234”原则
最后,陆舜教授总结了中国创新药发展的“1234”原则:一是始终以患者为中心,关注患者的需求和利益;二是坚持两个创新,即中国创新和国际创新,既要立足本土,又要放眼世界;三是追求三个价值,即科学价值、临床价值和商业价值的统一,实现三者的协调发展;四是依托四项科学,即基础科学、转化科学、临床科学和监管科学的综合支撑,为创新药的发展提供坚实的科学基础。
陆舜表示,未来他们将继续致力于肺癌领域的创新研究。同时,也将积极与全球顶尖的科研机构和制药企业合作。陆舜特别回忆了在与阿斯利康全球首席医疗官的交流中,他提出了晚期肺癌关键临床研究的问题,并得到对方的积极回应。此外,他还参与了强生制药肺癌药的临床研究,作为国际多中心临床试验的指导委员会委员,提出中国研究者的见解。
在谈到审评时间和效率时,他表示,以特瑞普利单抗的围手术适应症审批为例,从递交IND申请到获得批准,整个过程仅用了8个月。这充分证明了中国药监部门的高效和专业。陆舜说:“中国药监部门不仅严格把关,而且审批速度也很快。这对于我们新药研发来说是非常重要的支持。”
最后,陆舜希望中国的药企能够坚持创新,不断推出更多优秀的创新药物。“我相信,未来我们会看到更多中国创新药物的问世。”

来源:研发客


