您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-03-02 07:39
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
先为达NASH注射剂获批临床。先为达生物1类新药XW003注射液获国家药监局一项新的临床试验默示许可,拟开发用于非酒精性脂肪性肝炎(NASH)的治疗。XW003此前在国内已获批两项临床试验(2型糖尿病,和肥胖/超重患者体重管理),并在海外完成的I期临床中获得了积极的安全性、耐受性、药代及药效动力学数据。预计今年将开展多项代谢性疾病(糖尿病、肥胖症和NASH等)的II期临床试验。
国内药讯
1.康方生物派安普利单抗获FDA孤儿药资格。FDA授予康方生物派安普利单抗(AK105)用于治疗鼻咽癌的孤儿药资格。AK105是一款临床开发后期、具差异化的潜在“best-in-class” PD-1创新单抗。其通过在抗体Fc区引入突变,去除了Fc受体和补体介导效用功能,具有与抗原结合解离速率更慢的特征,能更有效地阻断PD-1通路的活性,并维持更强的T细胞抗肿瘤活性。
2.信达CD47/PD-L1双抗美国I期临床首例患者给药。信达生物首创CD47/PD-L1双特异性抗体IBI322在美国开展的I期临床首例患者给药。该项研究评估IBI322治疗在标准治疗失败的晚期恶性肿瘤受试者中的安全性、耐受性和抗肿瘤活性。临床前研究显示,IBI322可有效阻断SIRP-α与CD47结合,诱导巨噬细胞对表达CD47的肿瘤细胞发挥吞噬作用,能力与抗CD47单抗相当;IBI322同时也可有效阻断PD-1与PD-L1结合,激活CD4+T淋巴细胞,能力与抗PD-L1单抗相当。目前IBI322正在中美两国同步进行临床开发。
3.启愈生物双抗Q-1802获批美国临床。启愈生物宣布其PD-L1/Claudin18.2双特异性抗体Q-1802的新药临床试验获FDA批准,即将在美国开展临床研究。Q-1802是该公司的首个临床申报项目,由其抗体工程技术平台自主开发并拥有自主知识产权。在动物模型中,Q-1802的药效显示出优于PD-L1抗体和Claudin18.2抗体的联用,而且Q-1802可利用Claudin18.2抗体将PD-L1抗体特异性地靶向到肿瘤组织,显著降低系统暴露量,降低副作用。
4.国家药监局注销226个药品注册证书。3月1日,国家药监局发布了一则关于注销菠萝蛋白酶肠溶片等226个药品注册证书的公告。注销的226个药品中,有依申请注销的212个药品,不予再注册的14个药品。其中,注销药品注册证书最多的药企为江苏黄河药业(90个),其次为福州海王福药制药公司(25个)。
5.百奥泰2020业绩公布。百奥泰发布2020年业绩快报,报告期内实现营业收入18,498.99万元,主要为阿达木单抗药物2020年开始销售,报告期内实现销售收入18,286.36万元。公司全年实现归属于母公司所有者的净利润为-51,322.65万元,净亏损同比减少49.81% 。目前,国内已有4款阿达木单抗生物类似药获批上市,另有君实生物和正大天晴已申报上市。
6.君实与阿斯利康签署拓益独家推广协议。君实生物宣布与阿斯利康签署《独家推广协议》,阿斯利康获得拓益(特瑞普利单抗)在中国大陆地区后续获批上市的泌尿肿瘤领域适应症的独家推广权,以及所有获批适应症在非核心城市区域的独家推广权。君实生物继续负责核心城市区域除泌尿肿瘤领域适应症之外的其他获批适应症的推广。协议初始期限有效期为5个日历年。
国际药讯
1.“first-in-class”骨髓瘤疗法获FDA加速批准。FDA加速批准Oncopeptides公司肽偶联药物Pepaxto(melphalan flufenamide,melflufen)上市,与地塞米松联用,用于治疗既往接受过四项前期疗法(蛋白酶体抑制剂,免疫调节剂和CD38单抗)的复发/难治性多发性骨髓瘤(MM)成年患者。在一项Ⅱ期临床试验HORIZON中,这一组合在这类耐药患者中达到23.7%的总缓解率,中位缓解持续时间为4.2个月。Pepaxto也是FDA批准的首个抗癌肽偶联药物。
2.罗氏新冠抗体鸡尾酒疗法获EMA推荐批准。欧洲药品管理局人类用药品委员会(CHMP)推荐批准罗氏与再生元联合开发的新冠中和抗体鸡尾酒疗法(casirivimab和imdevimab)上市,用于治疗轻中度COVID-19患者。去年11月,FDA根据紧急使用授权(EUA)批准了这款鸡尾酒疗法,用于治疗确诊的成人和儿科患者(≥12岁,体重至少40公斤)轻中度COVID-19患者,以及进展为严重COVID-19和/或住院的高危人群。
3.辉瑞20价肺炎疫苗在欧盟进入审查。辉瑞20价肺炎球菌结合疫苗20vPnC的营销授权申请(MAA)获欧洲药品管理局(EMA)受理,用于18岁及以上成年人预防由疫苗中20种肺炎链球菌血清型引起的侵袭性疾病和肺炎。20vPnC包括了沛儿13(Prevnar 13)中的13种血清型,以及7种额外的血清型,这20种血清型是目前全球肺炎球菌疾病流行的主要原因。目前,20vPnC也正在接受FDA的优先审查,PDUFA目标日期为2021年6月。
4.艾伯维眼科药申报NDA。艾伯维与Allergan公司宣布,已向FDA提交AGN-190584(1.25%毛果芸香碱滴眼液)的新药上市申请(NDA),用于治疗老花眼。FDA预计将在2021年底做出审批决定。在两项III期研究(GEMINI 1和GEMINI 2)中,AGN-190584均达到主要终点指标,AGN-190584较安慰剂显著改善了昏暗条件下的近距离视力,并且没有造成远距离视力下降。研究中未报道任何治疗相关的严重不良事件。详细数据将于医学会议上公布。
5.新基/BMS抗体偶联药物CC-99712获FDA孤儿药资格。FDA授予新基与百时美施贵宝联合开发的BCMA靶向抗体偶联药物CC-99712孤儿药资格,用于治疗多发性骨髓瘤(MM)。CC-99712目前正在复发/难治性MM患者中开展多中心、开放标签、剂量发现Ⅰ期临床研究。多发性骨髓瘤是一种克隆性浆细胞异常增殖的恶性疾病,多发于老年人,目前仍无法治愈。
6.INOVIO启动拉沙热疫苗临床试验。INOVIO公司宣布其在研拉沙热DNA疫苗INO-4500在加纳进行的ⅠB期临床(LSV-002)首位受试者给药。该研究拟招募大约220名18-50岁的参与者,评估针对非洲人群的安全性和免疫原性。给药方案包括0天和28天两次接种。这是在拉沙热流行的西非地区进行的首次拉沙热疫苗临床试验,由流行病防范创新联盟(CEPI)全资推进。。
7.环状RNA疗法公司Orna完成A轮融资。Orna Therapeutics宣布完成8000万美元的A轮融资。本轮融资由MPM Capital、Taiho Ventures和F2 Ventures共同领投,跟投机构包括战略投资者Kite、BMS、安斯泰来风险投资公司、诺华生物医学研究所和PAGS集团。Orna致力于新型工程化环状RNA疗法(oRNA)的设计和递送,目标是克服线性mRNA疗法的局限,在癌症、自身免疫性疾病和遗传病等多种疾病中释放RNA的更多治疗潜力。所获资金将用于推动Orna首个项目启动IND申请和公司平台的建设。
医药热点
1.北京推进研究型创新型医院建设。2月26日,2021年北京市医院管理中心工作会议召开。会议透露,此前北京市布局的科技创新工作效果逐步显现,北京市属医院2020年科技创新收入达10.1亿元,同比增加3.05亿元,年增速达43.31%。在此基础上,北京市属医院今年将继续坚持创新驱动(绩效考核中将科技创新指标权重增加到20%),把持续推进研究型创新型医院建设作为年度重点工作。
2.刑法补充规定发布,10条罪名涉及制药人。最高人民法院、最高人民检察院公布了关于执行《中华人民共和国刑法》确定罪名的补充规定(七),3月1日施行。此次补充规定,有10条直接涉及药品相关领域,分别为:生产、销售、提供假药罪;生产、销售、提供劣药罪;妨害药品管理罪;妨害兴奋剂管理罪;食品、药品监管渎职罪;非法采集人类遗传资源、走私人类遗传资源材料罪;非法植入基因编辑、克隆胚胎罪;危害珍贵、濒危野生动物罪;非法猎捕、收购、运输、出售陆生野生动物罪;危害国家重点保护植物罪。
3.中国新冠期间各地超额死亡分析结果发表。《英国医学杂志(BMJ)》日前刊载了中国首个系统性分析新冠疫情期间全国各地超额死亡情况的研究结果。这项由中国疾控中心和湖北省疾控中心、武汉市疾控中心以及英国牛津大学研究人员共同开展的研究显示,2020年1月1日至3月31日期间,在全国采取的限制性防疫措施,不仅成功遏制住疫情的蔓延;而且与既往5年同期相比,降低了武汉之外许多地方的死亡率。
4.欧盟计划推出“疫苗护照”。据新加坡联合早报消息,欧盟27国领袖上周四在视频会议中一致对推行“疫苗护照”表示赞同。希望通过该护照和新冠检测等工具,恢复欧盟内部的人员流动。欧盟预计将在三个月内完成全欧适用的电子“疫苗护照”的开发工作。
审评动向
1. CDE新药受理情况(03月01日)
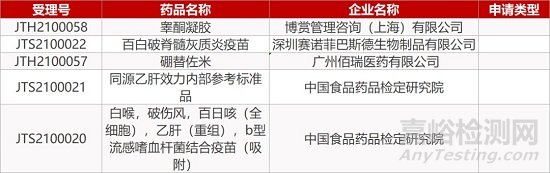
2. FDA新药获批情况(北美02月26日)
股市资讯
【科伦药业】(1)近日公司产品脂肪乳注射液(C14~24)通过一致性评价并获得药品补充申请批准通知书,主要用于胃肠外营养补充能量及必需脂肪酸;(2)近日公司产品甲硝唑氯化钠注射液通过一致性评价并获得药品补充申请批准通知书,主要用于治疗敏感厌氧菌引起的腹腔内感染、皮肤和软组织感染、妇科感染、下呼吸道感染等严重感染以及预防择期结直肠手术的术后厌氧菌感染。
【福安药业】近日公司子公司福安药业集团湖北人民制药有限公司产品注射用艾司奥美拉唑钠通过了仿制药质量和疗效一致性评价并获得药品补充申请批准通知书,该产品主要适用治疗口腹疗法不适用时,胃食管反流病的替代疗法,急性胃或十二指肠溃疡出血低危患者。
【三生国健】近日公司全资子公司美大制药收到国家药监局核准签发的注射用头孢唑肟钠《药品注册批件》,适应症包括敏感菌所致的下呼吸道感染、尿路感染、腹腔感染、盆腔感染、败血症、皮肤软组织感染、骨和关节感染、肺炎链球菌或流感嗜血杆菌所致脑膜炎和单纯性淋病。

来源:药研发


