您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-06-17 11:10
众所周知,口服固体制剂的溶出方法开发是个争论不休的大课题,如何以体外溶出行为评价体内行为,我们今天姑且不聊,主要聊一聊溶出度与溶出曲线方法学验证的具体内容。而溶出的检测方法常用的是紫外-可见分光光度法(UV法)和高效液相色谱法(HPLC法)两种。
本文主要适用于口服固体制剂以HPLC法检测溶出度和溶出曲线需要进行的方法学验证试验,UV法需要验证的内容大同小异,可根据实际情况加以调整,大体原则不变,现将具体内容汇总如下:
1.色谱条件的确定
溶出度的检测方法,首选以含量测定方法为原点进行优化。若含量测定方法合适,则可与其方法一致,省去一部分开发内容。但当含量测定采集时间较长时,建议优化方法,使溶出采集时间尽量短,否则一条溶出曲线的测定时间将非常漫长,在稳定性过程中的检测将更令人等到头秃,劳民伤财的事儿咱尽量不干。
值得关注的是,由于溶出曲线各种介质与含量测定所采用的溶剂不同,供试品溶液浓度也并不一致,故峰型柱效可能会有变化,故开发过程中应关注系统适用性要求。
另外有一种情况,主成分在某种溶出介质中很不稳定,产生降解杂质,需要将降解杂质含量与溶出量加和计算,此时的测定方法应能将降解杂质峰与主成分峰完全分离,方不影响测定结果。
2.分析方法的验证
按照惯例,先上一个汇总表概括说明验证内容:
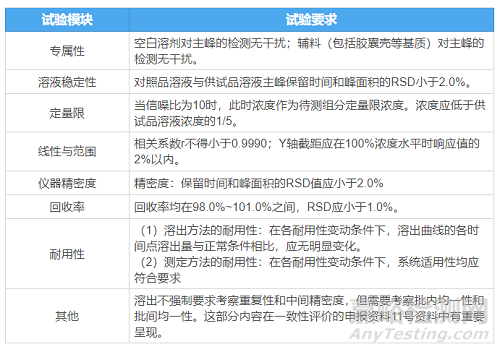
注:测定中各溶出介质均需进行方法学验证(耐用性可酌情减少实验,有时仅考察标准介质就具有一定的代表性了)。
下面,将方法学验证中的各项试验要求展开详述。
2.1专属性
目的:考察空白溶剂、空白辅料与待测主成分峰之间的分离情况。
空白溶剂、对照品溶液、供试品溶液:按拟定标准配制。
空白辅料溶液:空白辅料按处方比例混合后,按拟定标准配制(需考察胶囊壳等基质)。
需考虑图谱中肉眼可见的较大降解杂质与主成分的分离情况,必要时加和计算溶出量。溶出度不要求考虑普通杂质与主成分的分离情况,也不要求进行强制降解试验。
2.2溶液稳定性
目的:考察对照品溶液和供试品溶液配制后的稳定时间,为工艺验证、批检验、稳定性考察以及上市后的溶出度与溶出曲线测定提供依据。
系统适用性溶液视情况考察,对照品溶液与供试品溶液必须考察。
注意:溶液稳定性的考察时间也应针对具体情况,如采集时间较长,考察时间也应延长,目的是使后续检验更方便。当溶液不稳定时,重复考察避光条件或冷藏条件下是否稳定,视情况而选择规定溶液稳定性的考察时间。
2.3定量限
目的:为确保分析方法测定供试品含量的灵敏度。
定量限的概念:是指样品中被测物能被定量测定的最低量,其测定结果应具有一定的准确度。定量限体现了分析方法是否具备灵敏的定量检测能力。
将对照品溶液逐级稀释,当稀释至信噪比约为10时,此时浓度可作为定量限浓度。
溶出方法学并不强制要求做检测限。
注意:定量限结果受色谱系统影响较大,如色谱柱、流动相、色谱仪的状态,甚至次日试验的结果会与前一天不同,在这种情况下,若定量限浓度较低,应换用色谱系统再次测定,以确保方法的灵敏度。
2.4线性与范围
目的:在规定的浓度范围内,测定响应值(峰面积)与待测组分浓度呈比例关系的程度。
敲黑板——峰面积与浓度呈线性关系,是外标法的前提。
配制一份对照品母液,从中稀释配制成一系列不同浓度的线性溶液,至少制备5份(建议浓度点的总数为奇数),以测得的响应信号对待测物的浓度作图,检查是否呈良好的线性关系。
溶出度的线性溶液浓度要求:推荐为20%~150%。对于缓释制剂的溶出度,推荐为0~150%。注意线性溶液的最低浓度应大于定量限浓度,并应涵盖溶出曲线测定的最低浓度点。线性的浓度点尽量均匀分布。
2.5仪器精密度
目的:为保证仪器每次所测对照品溶液峰面积均一致,以确保结果的准确性,设计仪器精密度试验。
取对照品溶液,连续进样6次。考察保留时间和峰面积的RSD%。
2.6回收率
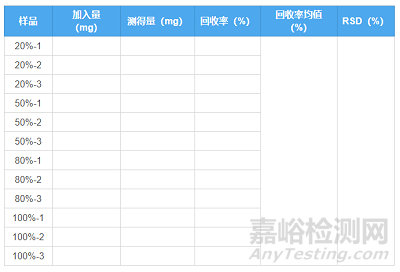
目的:考察采用拟定方法测定结果与真实值或参考值接近的程度,也叫做回收率试验。用至少测定6份结果进行评价,或设计3种不同浓度,每个浓度平行配制3份。
按照拟定质量标准配制空白溶剂、对照品溶液。
回收率供试品溶液:按处方比例混合的空白辅料+主成分对照品,再按照拟定质量标准配制溶液。
不同于含量测定,溶出曲线过程中会涉及到较低浓度点,故回收率推荐设计较低浓度,保证在溶出行为测定的整个过程中,该方法都是较为准确的。回收率验证的范围必须囊括100%浓度水平。浓度范围一般要求为限度的±20%,高浓度点可适当调整至110%。
回收率结果报告表格推荐内容如下:
2.7耐用性
针对耐用性,若涉及到的各溶出介质都去做一遍,工作量就过于庞大了。故推荐至少考察标准介质中的耐用性即可,其他介质视情况考察。
(1)溶出方法的耐用性
目的:考察溶出条件发生微小变化时,各时间点溶出量的变化情况。
还是列表说明推荐的变动条件:
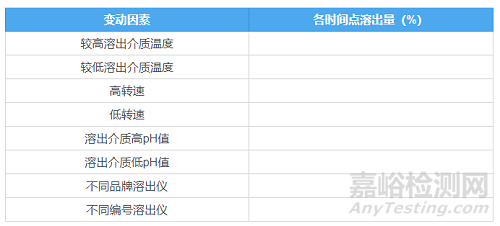
根据品种特点考察耐用性,推荐但不仅限于上述变动条件。还有很多需要注意的方面,比如表面活性剂的浓度和不同厂家、不同缓冲液浓度、配制介质的水的脱气条件等,都是需要研究者在试验过程中予以关注的细节。
(2)测定方法的耐用性
这一个模块的内容与含量测定耐用性要求基本一致。
目的:考察色谱条件发生微小变化时对测定结果的影响。
按照拟定标准配制空白溶剂、对照品溶液和供试品溶液(系统适用性溶液视情况配制),计算不同条件下供试品的含量测定结果,关注系统适用性是否符合标准要求(有时方法中并不拟定配制系统适用性溶液,而是规定主峰理论板数和拖尾因子等,也要相应关注和统计)
同样放一张表格,将耐用性试验内容和结果要求直观呈现如下:
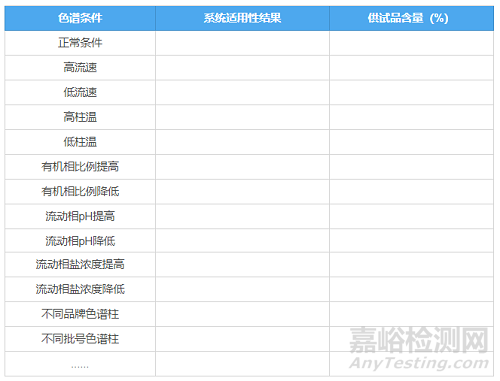
耐用性考察的内容可能还有很多,请各位根据实际情况增减。另外,有时几个条件同时变化的情况下是否耐用,也是需要考察的。但考察叠加条件工作量较大,可自行选择较为重要的条件进行考察。耐用性试验时,观察峰型和结果的变化趋势,后续检验一旦出现问题,可以通过现象推测偏差原因,及时解决问题。
注意:变化不同色谱条件时,切记根据需要延长采集时间。
当变动条件后测定结果与正常条件基本一致,且系统适用性指标符合标准规定,即可下测定方法耐用的结论。
2.8批内均一性和批间均一性
这两项指标既是检验企业产品的标杆,同时也是检验溶出方法是否精密的标杆。
批内均一性:取同一批次产品的12个剂量单位(有时6个剂量单位也能够满足考察要求,比如快速溶出等情况),测定溶出曲线,计算各取样时间点的RSD值。其中,早期的一些取样时间点(如5min),要求RSD≤20%;其他时间点,要求RSD≤10%。
批间均一性:取不同批次产品的12个剂量单位(有时6个剂量单位也能够满足考察要求,比如快速溶出等情况),测定溶出曲线,比较各批次的溶出曲线是否相似。
3.注意事项
3.1质量标准写法
中国药典2015年版二部中所载各品种,即便是缓释制剂,对这一项检查也不再写成“释放度”而是写成“溶出度”,因此在撰写药典版质量标准时,推荐按照药典规范写法。
3.2方法学验证的范围
验证范围包括但不仅包括该品种的各常规介质。
若该制剂涉及到剂量倾泻的考察,应进行加入一定量乙醇介质中的溶出方法学验证。
若需考察该产品在生物介质中的溶出行为,则应进行生物介质中的溶出方法学验证。
总之,有的放矢,有据可依,检测做了什么,方法就需验证什么。
3.3配制过程中的溶剂问题
当主成分在相应溶出介质中难溶时,在方法学验证中可使用少量有机溶剂先使其溶解(线性、回收率等试验),再用相应溶出介质稀释定容,但最终进样分析的供试品溶液中,有机溶剂的比例应不超过总体积的5%。

来源:铭研医药


