您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-06-29 12:03
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
江苏先声VEGF品种上III期临床。先声药业VEGF单抗赛伐珠单抗(注射用BD0801)III期临床首例受试者入组和给药。该研究由中国医学科学院肿瘤医院吴令英教授牵头,旨在评价BD0801联合化疗(紫杉醇、多柔比星脂质体或拓扑替康)对比安慰剂联合化疗在含铂化疗方案治疗失败的复发性上皮卵巢癌、输卵管癌和原发性腹膜癌患者中的有效性和安全性。
国内药讯
1.奥布替尼获FDA突破性疗法认定。诺诚健华自主研发的BTK抑制剂奥布替尼获FDA授予突破性疗法认定,用于治疗复发/难治性套细胞淋巴瘤(R/R MCL)。去年年底,FDA已授予奥布替尼用于治疗MCL的孤儿药资格。在中国,奥布替尼于去年年底获NMPA批准上市,用于治疗复发/难治慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)、以及R/R MCL两项适应症。
2.信达IBI362减重Ⅰ期临床积极。信达生物GLP-1R/GCGR双激动剂IBI362用于中国肥胖或超重人群中减重的Ⅰ期临床结果积极。连续用药12周后,IBI362不同剂量受试者的平均体重较基线分别下降3.80 kg(4.81%),5.77 kg(6.40%)和5.12 kg(6.05%),而安慰剂组受试者平均体重较基线增加0.37 kg(0.60%);同时,IBI362组受试者的腰围、BMI、血压和血脂等指标也有不同程度改善。临床中,IBI362各剂量耐受性良好,安全性可控。
3.江苏吴中抗肿瘤新药获批临床。江苏吴中宣布,其控股子公司苏州泽润1类新药YS001胶囊获国家药监局临床试验默示许可,即将于近期开展用于治疗晚期恶性实体瘤的临床试验。YS001胶囊是苏州泽润自主研发并拥有完全自主知识产权的PI3K/mTOR双靶点抑制剂,已获得中国发明专利授权。其研发的目标适应症为乳腺癌、肾癌、胃癌、卵巢癌等晚期恶性实体瘤。
4.君实回应美国暂停供应新冠双抗体疗法。君实生物28日发布公告,就美国卫生部门日前宣布停止分发礼来/君实的新冠中和抗体组合疗法一事作出回应。君实生物强调,美国暂停供应新冠双抗体疗法并非撤回其在美国的紧急使用授权(EUA),未来双抗体疗法仍有可能在美国恢复使用。君实生物还强调,礼来和君实生物的新冠中和抗体组合疗法对其他突变病毒株有效。
5.士泽生物完成天使轮融资。士泽生物宣布已完成数千万级天使轮融资。本轮融资由峰瑞资本领投,泰达科投和元生创投跟投。士泽生物成立于2021年,致力于为帕金森病等一系列尚无临床解决方案的重大疾病提供规模化、低成本的干细胞治疗方案,公司创始人、首席执行官为李翔博士。此轮融资相继用于该公司前期研发中心落地,支持团队全职到位、启动关键研发实验等。
国际药讯
1.Libtayo获欧盟批准新适应症。欧盟委员会(EC)批准赛诺菲与再生元联合开发的PD-1疗法Libtayo(cemiplimab)新适应症,作为一种单药疗法,用于一线治疗PD-L1(TPS≥50%)高表达、不适合手术切除或放化疗、转移性/局部晚期的非小细胞肺癌(NSCLC)患者;用于接受一种hedgehog通路抑制剂(HHI)治疗但病情进展或对该类药物不耐受的局部晚期/转移性基底细胞癌患者。此前,Libtayo已在欧盟获批,用于治疗晚期皮肤鳞状细胞患者。
2.BCMA靶向CAR-T疗法获欧洲CHMP支持。欧洲药品管理局人用医药产品委员会(CHMP)推荐批准百时美施贵宝BCMA靶向CAR-T疗法Abecma(idecabtagene vicleucel,ide-cel)有条件上市,用于治疗复发性/难治性多发性骨髓瘤(R/R MM)成人患者,这些患者之前至少接受过三种治疗,包括免疫调节剂、蛋白酶体抑制剂和抗CD38抗体。Abecma是全球首款获得监管批准的BCMA CAR-T疗法,今年3月获FDA批准治疗多发性骨髓瘤。
3.基因编辑治疗ATTR早期临床积极。诺奖得主Jennifer Doudna博士创建的基因编辑公司Intellia与再生元宣布,双方合作开发的CRISPR/Cas9基因编辑疗法NTLA-2001,在治疗转甲状腺素蛋白淀粉样变性(ATTR)患者的Ⅰ期临床中获积极初步结果。单剂NTLA-2001导致血清中的转甲状腺素蛋白水平(TTR)平均下降87%,在第28天TTR降低幅度最大可达96%;而且NTLA-2001的安全性良好,前6例患者第28天时没有出现严重不良事件。
4.RNAi疗法治疗乙肝最新结果积极。Arbutus Biopharma公司在ILC2021年会上公布其肝细胞靶向RNAi疗法AB-729长期给药的有效性和安全性数据。长达一年的治疗数据显示AB-729具有良好的安全性和耐受性;所有给药方案均导致HBsAg显著下降,75%(15/20)的受试者HBsAg下降至100 IU/mL以下;在可评估受试者中,可观察到HBV特异性T细胞的增殖,或HBV特异性T细胞表达的IFN- γ水平升高。
5.吉利德治疗HDV新药最新临床积极。吉利德公布首创抗病毒药物Hepcludex(bulevirtide)治疗慢性丁型肝炎病毒(HDV)感染的Ⅱb期MYR204研究和Ⅲ期MYR301研究的中期结果。在MYR301研究中,bulevirtide (2mg和10mg)治疗组24周时分别有36.7%和28%的患者达到病毒学和生物化学联合应答,而对照组这一数值为0%。在评估bulevirtide单药或联合聚乙二醇干扰素α-2a治疗HDV患者的MYR204研究中,bulevirtide单药组24周时达到联合应答的患者比例最高;bulevirtide单药或联合用药的耐受性良好。
6.罗氏终止眼病基因治疗合作。罗氏宣布将终止与4D Molecular Therapeutics合作,结束针对眼病基因治疗4D-110的开发支持,并将该新药的权利交还给4D Molecular公司。在一项4D-110用于治疗晚期无脉络膜血症患者的早期试验中,该疗法耐受性良好,未出现与治疗相关的剂量限制性毒性事件。4D-110的初步生物活性数据预计将在今年第四季度公布。据分析,罗氏终止合作可能是这些数据显示有效载荷的递送不佳以及该疗法使用了已知的可刺激免疫反应的载体。
医药热点
1.6岁以下儿童可享13次视力服务。6月23日,国家卫健委办公厅印发《0~6岁儿童眼保健及视力检查服务规范(试行)》。《服务规范》明确,由具备相应服务能力的乡镇卫生院、社区卫生服务中心等基层医疗卫生机构,或县级妇幼保健机构及其他具备条件的县级医疗机构,为0~6岁儿童提供13次眼保健和视力检查服务。
2.广州本轮疫情危重症和重症全部清零。6月28日上午,广州市卫健委新闻发言人陈斌通报了广州市新冠病例情况:6月19日至27日24时,广州市连续九天无新增境内感染病例报告。本轮疫情,全市累计报告153例感染者,包括146例确诊病例和7例无症状感染者。目前尚有58例境内确诊患者在市八人民医院接受治疗。截至6月27日,本轮疫情所有危重症和重症患者全部清零。
3.钟南山:Delta毒株改变了密接者的概念。钟南山院士25日表示,由于Delta变异株患者的病毒载量高,呼出病毒浓度大,传染性极强,所以过去的密接概念已不适用。针对Delta变异株,在同一个空间、同一单位、同一建筑与感染者发病前4天曾经相处的,都是密接者。因为概念的改变,广州分级制定了封闭、封控等不同的管控模式,在应对Delta毒株在社区传播取得了阶段性的重大成果。
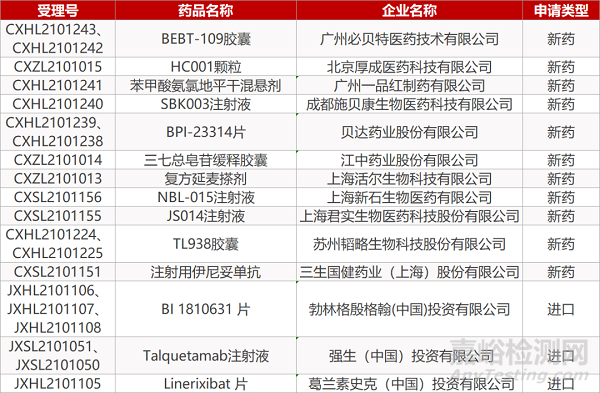
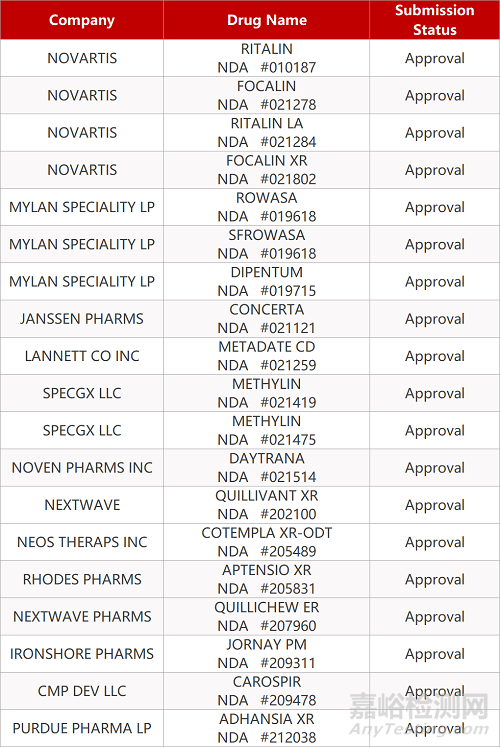
审评动向

来源:药研发