您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-08-18 11:31
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
和剂药业ITK抑制剂报IND。和剂药业口服ITK抑制剂CPI-818的临床试验申请获CDE受理,拟用于复发/难治性T细胞淋巴瘤患者的治疗。CPI-818在美国、韩国、澳大利亚进行的首次人体试验中,已显示出确切的疗效和良好的安全性及耐受性。在原发性皮肤T细胞淋巴瘤(CTCL)患者中,1例CTCL-Sezary综合征患者的靶淋巴结出现缩小,且无正子造影 (FDG)活性病灶,淋巴结达到完全缓解 (CR);在剂量递增阶段,CPI-818(≥200 mg) BID治疗的7例PTCL-NOS患者中,有2例患者达到缓解。
国内药讯
1.国药新冠疫苗无发生血栓风险。国药中生新冠灭活疫苗在406例医护人员中评估疫苗接种后是否会促进血栓相关自身抗体的产生及是否会增加血栓事件风险的前瞻性研究成果发表在Science Bulletin上。结果显示:第1剂疫苗接种前,入组者新冠抗体阳性率为0,第二剂疫苗接种4周后,新冠抗体血清转化率为95.81%。自身抗体的阳性率及抗体水平在接种前后采集的样本中没有显著差异。在最少8周的随访期内,所有入组者均未出现血栓事件及血小板减少。因此,新型冠状病毒灭活疫苗未影响抗磷脂抗体和抗PF4-肝素抗体的水平,同时不增加血栓形成的风险。
2.信达PD-1抑制剂治疗胃癌Ⅲ期临床积极。信达生物与礼来联合开发的PD-1抑制剂信迪利单抗,联合化疗在一项一线治疗胃癌的Ⅲ期临床ORIENT-16中达主要终点。与安慰剂联合化疗相比,这一联合治疗显著延长患者的总生存期(OS);而且安全性特征与既往研究一致,无新的安全性信号。详细结果将于国际学术会议上公布。信达生物计划就递交信迪利单抗的该新适应症上市申请与CDE进行沟通。
3.HER2双抗液体制剂获批临床。NMPA批准康宁杰瑞HER2双抗KN026药学变更的补充申请,同意后续可采用液体制剂开展临床研究。KN026液体制剂有望提供更加便利的给药方式,并为开发皮下注射制剂奠定基础。目前KN026正在中美同步临床开发,正在多项Ⅰ/Ⅱ期临床中,评估治疗HER2低表达或阳性乳腺癌、晚期HER2阳性胃和胃食管结合部癌及其他HER2阳性实体瘤等适应症的潜力。
4.多纳非尼治疗晚期结直肠癌III期临床失败。泽璟制药甲苯磺酸多纳非尼片治疗二线以上晚期结直肠癌III期临床错失主要疗效终点。与对照组相比,多纳非尼治疗组患者的中位总生存期(mOS)未达到预设的优效目标。目前泽璟制药已终止多纳非尼单药治疗该适应症的进一步开发。2021年6月,多纳非尼一线治疗晚期肝细胞癌适应症已获国家药监局批准上市。
5.诺诚健华引进CD19单抗大中华区权益。诺诚健华旗下子公司与Incyte公司就Incyte一款CD19单抗tafasitamab在大中华区的开发和独家商业化签订合作和许可协议。Tafasitamab已获FDA加速批准,与来那度胺联合用于治疗复发或难治性弥漫性大B细胞淋巴瘤 (DLBCL) ,包括由低恶性淋巴瘤演进而来的DLBCL以及不适合自体干细胞移植的患者。根据协议,Incyte将获3500万美元首付款,可能达8250万美元的里程碑付款以及产品的销售分成。
6.亘喜拟开发CLDN18.2靶向细胞疗法。亘喜生物与明济生物正式签署一项独家授权协议,将联合开发Claudin 18.2(CLDN18.2)靶向新型细胞疗法,以治疗CLDN18.2阳性实体瘤。CLDN18.2是一种具有四个跨膜区和两个细胞外环的小型跨膜蛋白,在胃或胃食管结合部癌、胰腺癌和食管癌等多种肿瘤组织中高表达。根据协议,明济生物将获得预付款,基于非临床验证、临床开发及商业化成果的里程碑款项以及产品销售分成。
国际药讯
1.默沙东抗新冠病毒口服药物在加拿大报NDA。默沙东口服抗新冠病毒药物molnupiravir(MK-4482/EIDD-2801)向加拿大卫生部滚动提交上市申请。一项公布于ECCMID2021会议上的Ⅱ/Ⅲ期MOVe-OUT临床中的Ⅱ期中期结果显示,在症状出现<5天的非住院COVID-19患者中,该新药表现出最大疗效。目前该试验的Ⅲ期正在进行中,1550例患者口服molnupiravir或安慰剂治疗5天,将通过从随机分组至第29天期间住院/死亡的患者百分比来评估molnupiravir与安慰剂的疗效。
2.礼来湿疹抗体疗法两项Ⅲ期临床积极。礼来IL-13靶向单抗lebrikizumab在中重度特应性皮炎(AD)的两项关键性Ⅲ期临床(ADvocate 1和ADvocate 2)中均达到主要终点和所有关键次要终点。与安慰剂相比,lebrikizumab使超过一半的患者的皮肤症状改善至少75%(EASI 75);而且患者的瘙痒症状以及与瘙痒有关的睡眠干扰和生活质量均有显著改善;安全性与既往研究一致。详细结果将在2022年的科学会议上公布。FDA此前已授予lebrikizumab快速通道资格。
3.肾病创新疗法Ⅲ期结果积极。Travere公司内皮素/血管紧张素受体拮抗剂sparsentan治疗IgA肾病(IgAN)的关键性Ⅲ期临床PROTECT达到主要终点。与活性对照组相比,sparsentan治疗组36周后患者的蛋白尿较基线平均减少了49.8%(vs15.1%,p<0.0001);sparsentan通常耐受良好,安全性与已知研究一致,未出现新的安全性信号。该公司计划于2022年上半年使用加速批准通路递交新药申请。
4.阿斯利康创新LIF单抗上II期临床。阿斯利康LIF单抗AZD0171(MSC-1)在美国临床网登记启动一项II期临床,联合PD-L1单抗度伐利尤单抗和化疗(吉西他滨和白蛋白结合型紫杉醇)一线治疗胰腺导管腺癌(PDAC)。该项研究计划招募115例受试者,预计将于2023年11月结束。AZD0171是Northern Biologics公司开发的一款“first-in-class”抗体药物。目前,全球尚无用于PDAC的免疫疗法获批。
5.乙肝功能性治愈潜在疗法启动临床。Enanta公司拟用于治疗慢性乙型肝炎病毒(HBV)感染的新型PAPD5/PAPD7抑制剂EDP-721,在Ⅰ期临床中完成首例受试者给药。PAPD5和PAPD7两种蛋白是维持HBV的RNA稳定的关键宿主因子。在临床前研究中,EDP-721可以使HBV模型小鼠的HBsAg降低高达3 log10 IU/mL;而且与核苷酸逆转录酶抑制剂或EDP-514联用时,EDP-721在体外也显示出协同抗病毒活性。
6.Moderna儿科遗传病mRNA疗法上临床。Moderna公司在研疗法mRNA-3705在治疗甲基丙二酸血症(MMA)的Ⅰ/Ⅱ期临床中完成首例患者给药。MMA是一种危及生命的罕见遗传性代谢疾病,主要是由于甲基丙二酸单酰辅酶A变位酶(MUT)缺失而导致。目前,肝脏或肝肾联合移植是唯一有效的治疗方法。mRNA-3705由编码人类MUT的mRNA组成,旨在指导机体恢复MUT的表达。此前,FDA已授予mRNA-3705孤儿药和罕见儿科疾病认定。
医药热点
1.四川将建中西医结合“旗舰”医院。四川省推进中医药强省建设工作领导小组日前印发《关于坚持中西医并重加快中西医结合的实施意见》。《意见》指出,要优化中西医资源布局,建立完善全省中西医服务体系。力争建设1~2个国家中西医医学中心或区域医疗中心,建设一批国家级和省级中西医结合“旗舰”医院、“旗舰”科室。
2.慢性病患者最长可开12周长处方。国家卫健委日前印发《长期处方管理规范(试行)》。长期处方是指具备条件的医师按照规定,对符合条件的慢性病患者开具的处方用量适当增加的处方。《规范》明确,长期处方的处方量一般在4周内;根据慢性病特点,病情稳定的患者适当延长,最长不超过12周。超过4周的长期处方,医师应当严格评估,强化患者教育,并在病历中记录,患者通过签字等方式确认。
3.北京医保个人账户可支付配偶子女医疗费。北京市医保局日前发布《关于城镇职工基本医疗保险个人账户使用范围的补充通知》,明确城镇职工基本医疗保险个人账户可用于支付参保人员配偶、父母、子女在定点医疗机构就医、定点零售药店发生的由个人负担的医疗费用。通知自发布日起实施。
4.美国最早秋季启动新冠疫苗加强针接种。美国国家卫生研究院院长弗朗西斯·柯林斯15日表示,联邦政府可能在几周内决定,是否于秋季开始给医护人员、养老院住户及其他老年人接种新冠疫苗加强针。现阶段,美国平均每日新增新冠确诊病例大约12.9万例,较7月初增加700%,且未来几周可能增至每日20万例。
评审动态
申请临床:
山东盛迪的HRS-8080片(2个规格)、康诺亚的CM326注射液、江苏豪森的HS-10342片、正大天晴药业集团南京顺欣制药的TQB2928注射液、康方药业的AK104注射液(2个规格)、杭州泰格的Difelikefalin注射液、强生的JNJ-63733657注射液、百时美施贵宝的Relatlimab/Nivolumab固定剂量复方注射液。
申请生产:
大连万春布林医药的注射用普那布林浓溶液。
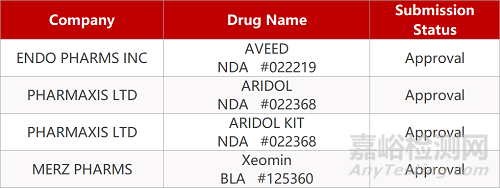
2. FDA新药获批情况(北美08月16日)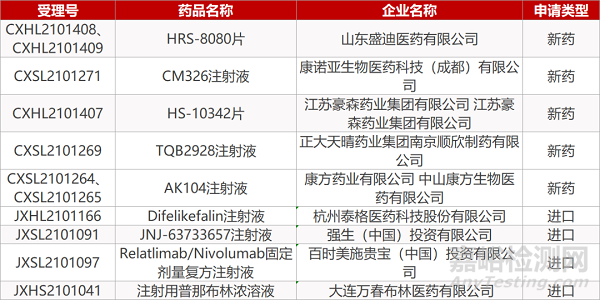

来源:药研发


