您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-09-02 12:20
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
齐鲁地舒单抗生物类似药报产。齐鲁制药地舒单抗注射液的上市申请获CDE受理。这是国内首款报产的地舒单抗生物类似药。地舒单抗(安加维®)是安进开发的一款特异性靶向核因子κB受体活化因子配体(RANK-L)的抗体,目前已在国内获批用于治疗不可手术切除或者手术切除可能导致严重功能障碍的骨巨细胞瘤;骨折高风险的绝经后妇女的骨质疏松症;以及用于多发性骨髓瘤和实体瘤骨转移患者中骨相关事件的预防。
国内药讯
1.杨森潜在FIC双抗国内获批临床。强生旗下杨森1类新药talquetamab注射液获国家药监局临床试验默示许可,拟开发用于多发性骨髓瘤。这是一款靶向GPRC5D的潜在“first-in-class”双抗疗法,已在治疗多发性骨髓瘤的Ⅰ期临床中获得积极结果。中位随访为6.3个月时,在推荐的Ⅱ期剂量下皮下给药治疗的总体应答率为70%,包括60%的非常好的部分缓解。
2.诺诚健华ICP-723在美获批临床。诺诚健华1类创新药ICP-723获FDA临床许可。ICP-723是诺诚健华在全球拥有自主知识产权的第二代泛TRK小分子抑制剂,用于治疗携带NTRK融合基因的晚期或转移性实体瘤,包括乳腺癌、结直肠癌、肺癌、甲状腺癌等,以及对第一代TRK抑制剂产生耐药的患者。该新药目前正在国内开展Ⅰ期剂量递增(1毫克、2毫克、3毫克和4毫克)研究。
3.君实IL21融合蛋白获批临床。君实生物IL21融合蛋白JS014获CDE临床试验默示许可,拟用于晚期恶性肿瘤的治疗。JS014是国内首款IL21/HSA融合蛋白,由君实从Anwita公司引进。全球范围内,已有4款同靶点产品进入临床。除JS014外,两款单抗ATR-107(PF-05230900)和 avizakimab(BOS161721)分别处于临床I期和II期阶段;安进的AMG256为PD-1/IL21双功能融合蛋白,已启动1项I期临床。
4.京新药业引进癫痫新药开发权益。浙江京新药业与韩国Bio-Pharm Solutions公司签署《许可、开发、商业化和供应协议》。根据协议,京新药业获得后者癫痫1类新药JBPOS0101两个适应症(婴儿痉挛症和局灶性癫痫)在中国地区(包含中国大陆、香港、澳门)研发、生产及商业化的独家权益。B-PS公司将获得500万美元的首付款、最高不超过3500万美元的里程碑付款、以及产品的销售分成。
5.中国生物上半年净利润增长583.6%。中国生物制药发布2021年半年业绩报告,上半年营收143.54亿元,同比增长13.5%,新产品销售收入占总收入比例从去年的34.8%提升至43.9%;净利润84.8亿元,同比增长583.6%;研发投入18.81 亿元(+22.1%),占营收13.1%。联营企业并表盈利约75.85亿元,主要来源于科兴中维新冠疫苗的销售收入。而基于中国生物制药拥有科兴中维15.03%权益,推测科兴中维上半年新冠疫苗盈利达到504亿元人民币。
国际药讯
1.Keytruda治疗晚期膀胱癌获FDA完全批准。默沙东宣布,FDA批准PD-1疗法Keytruda一线治疗晚期尿路上皮癌的标签更新,并将该适应症修订为用于治疗不适合接受任何含铂化疗方案的局部晚期或转移性尿路上皮癌(mUC)患者。此次由加速批准转为完全批准是基于FDA肿瘤药物咨询委员会(ODAC)会议上专家的投票结果。在确证性Ⅲ期试验KEYNOTE-361中,与化疗相比,Keytruda没有达到总生存期或无进展生存期的双重主要终点。
2.PCSK9抑制剂降血脂Ⅲ期临床积极。安进在ESC 2021年会上公布PCSK9抑制剂类新型降胆固醇药物Repatha(瑞百安®,依洛尤单抗,evolocumab)Ⅲ期HUYGENS研究的阳性结果。与仅使用优化的他汀类治疗相比,Repatha联合治疗显著增加冠状动脉疾病(CAD)患者纤维帽厚度(增加:42.7umvs21.5um;增加幅度:75%vs39%;p=0.01),提高斑块稳定性;Repatha还改善所有次要终点,包括OCT测量的最大脂质弧降低-57.5vs-31.4(p=0.01)。
3.拜耳神经激肽拮抗剂上Ⅲ期临床。拜耳宣布启动“first-in-class”非激素神经激肽-1,3受体(NK1R、NK3R)拮抗剂elinzanetant治疗更年期血管舒缩症状(潮热)的国际Ⅲ期临床OASIS。计划在20多个国家招募约1300例患者,评估elinzanetant每日一次120mg对有血管舒缩症状的更年期女性的疗效和安全性。Elinzanetant已在2项Ⅱ期研究(RELENT-1和SWITCH-1)中取得积极数据,详细数据将于NAMS2020年会上公布。
4.自体CAR-T疗法治疗实体瘤早期临床积极。Poseida公司自体PSMA -CAR-T疗法P-PSMA-101治疗转移性去势抵抗性前列腺癌(mCRPC)的Ⅰ期临床结果积极。接受低剂量治疗的9例患者中,有5例患者PSA水平显著下降,其中3例患者的PSA水平下降超过50%,PSMA-PET成像一致改善;1例患者肿瘤完全消除,并保持5个月以上的持久缓解;P-PSMA-101表现出良好的安全性和耐受性特征。
5.Versanis拟推进开发肥胖症新疗法。Versanis Bio公司完成7000万美元的A轮融资,以启动一项综合Ⅱ期临床项目,评估bimagrumab帮助肥胖患者减脂和改善身体肌肉脂肪比的潜力。Bimagrumab是诺华开发的一款拟用于治疗代谢疾病和肥胖症的ActRII靶向单抗。在一项Ⅱ期临床中,bimagrumab使2型糖尿病和肥胖患者全身脂肪量减少可高达20.5%,瘦体重增加可高达3.6%,并改善了血糖水平。
6.SpringWorks拟开发BCMA靶向疗法组合。SpringWorks公司与丹娜-法伯癌症研究所达成一项研究合作,将在多种临床前多发性骨髓瘤模型中,进一步研究其口服特异性γ分泌酶小分子抑制剂nirogacestat,并利用功能基因组学方法,探索γ分泌酶抑制剂+BCMA联合治疗应答的决定因素和耐药机制。SpringWorks将负责研发项目的资金,并保留合作中出现的任何新知识产权的独家许可权益。Nirogacestat目前处于治疗硬纤维瘤的Ⅲ期临床开发阶段。
医药热点
1.FDA疫苗审查办正、副主任将离职。据Endpoints News报道,FDA生物制品评价和研究中心(CBER)下属的疫苗研究与审查办公室(OVRR)主任Marion Gruber将于10月底离职,副主任Phil Krause将于11月离职。FDA目前正在审查新冠疫苗的加强针和在儿童群体中的应用。但美国政府已对外宣布,自9月20日起向公众提供新冠疫苗加强针。两人的离开或许与CDC和接种谘询委员会(ACIP)施压有关。
2.深化医疗服务价格改革试点方案发布。31日,国家医保局等八部门联合发布《深化医疗服务价格改革试点方案》,通过3至5年的试点,探索形成可复制可推广的医疗服务价格改革经验。到2025年,深化医疗服务价格改革试点经验向全国推广,分类管理、医院参与、科学确定、动态调整的医疗服务价格机制成熟定型,价格杠杆功能得到充分发挥。
3.山东省出现炭疽死亡病例。根据《中国疾病预防控制中心周报(英文)》8月27日发布的报告,截至8月15日,山东省疾控中心报告滨州2例炭疽确诊病例,1例是一名14岁的学生(已于8月6日死亡),根据脑脊液、血清抗体以及血培养检查,死亡原因专家初步判断是由败血症引起的肠炭疽或脑膜型炭疽;另1例是一名从事屠宰工作的35岁男子,已被转移至传染病医院进行隔离治疗。
评审动态
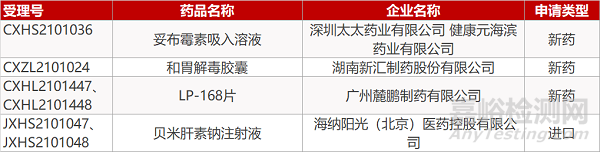
申请临床:
湖南新汇制药的和胃解毒胶囊、广州麓鹏制药的LP-168片(2个规格)。
申请生产:
深圳太太药业/健康元海滨药业的妥布霉素吸入溶液、海纳阳光的贝米肝素钠注射液(2个规格)。
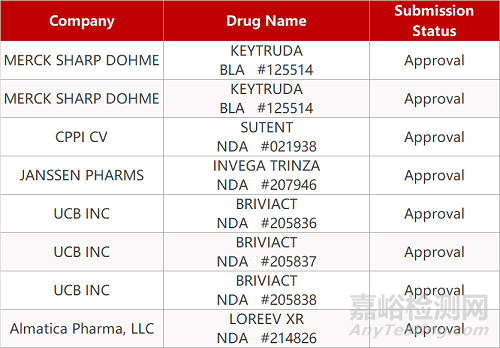
2. FDA新药获批情况(北美08月31日)

来源:药研发


