您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-09-30 10:47
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
天境B7-H3单抗报实体瘤IND。CDE受理天境生物B7-H3抑制剂依布妥组单抗(TJ271)联合PD-1单抗Keytruda治疗实体瘤的II期临床试验申请。这是一项“篮式”研究,旨在评估这一组合治疗多种实体瘤的疗效,包括非小细胞肺癌(NSCLC)、尿路上皮癌等瘤种。在Ⅰ期扩展队列研究中,TJ271联合PD-1单抗治疗复发性/转移性头颈部鳞状细胞癌(SCCHN)的ORR达到33.3%;治疗PD-L1≤1%的NSCLC患者的ORR达到35.7%。
国内药讯
1.康方PD-1/VEGF双抗最新临床数据公布。康方生物将在CSCO2021年会上公布PD-1/VEGF双抗AK112联合化疗一线治疗晚期非小细胞肺癌II期临床第一部分队列1的初步数据。在26例可评估患者中,研究者评估的ORR为53.8%,DCR为100%,其中12例SD受试者肿瘤均缩小。7例高剂量组(20mg/kg)受试者中,ORR为57.1%,DCR为100%,其中3例SD受试者肿瘤分别缩小23.9%、27.3%、29.4%。未发现PD-1抑制剂和VEGF单抗之外的新的安全性信号。
2.新一代ROS1/NTRK抑制剂临床积极。葆元医药与信达生物在CSCO2021大会上公布新一代ROS1/NTRK抑制剂taletrectinib用于ROS1阳性非小细胞肺癌(NSCLC)的Ⅱ期试验中期数据。在未接受过克唑替尼治疗的21例患者中,经确认的ORR为90.5% ,DCR为90.5%;在曾接受过克唑替尼治疗的16例患者中,经确认的ORR为43.8%,DCR为75.0%;在脑转移患者中,研究者评估的颅内客观缓解率为83.3%。此外,taletrectinib具有良好的耐受性。
3.康宁杰瑞与瑞臻医药开展联合用药研究。康宁杰瑞PD-L1/CTLA-4双抗KN046拟与瑞臻医药抗肿瘤小分子药物RG001联合开展临床试验。两家公司将以联合或序贯用药的合作方式,评估KN046联合RG001治疗晚期肝癌(HCC)、晚期肝转移性结直肠癌(CRC liver metastasis)及双方共同决定的其他适应症的安全性和有效性,有望为接受化疗、小分子靶向治疗/PD-1治疗后进展的患者,带来新的治疗选择。
4.江苏瑞科与深圳瑞吉合作布局mRNA疫苗。江苏瑞科与深圳市瑞吉生物签署合资协议,成立合资公司“武汉瑞科吉生物科技有限公司”,着力展开mRNA疫苗领域深入、广泛的研发及产业化合作,打造创新型疫苗企业。合资公司由瑞科生物控股,落地武汉光谷。合资公司将利用mRNA技术和新型佐剂技术开发新一代新冠疫苗,并计划逐步拓展至其他重大传染病疫苗和肿瘤治疗性疫苗。
5.百克生物终止与思安信新冠疫苗合作。长春百克生物及母公司长春高新宣布,将终止与广州思安信生物关于新冠病毒疫苗(PIV-5 载体)的许可合作关联交易。思安信在研新冠疫苗目前正在美国开展I期临床试验。思安信不同意在没有签署正式协议前提下移交生物材料用以开展验证性实验。合作协议尚未正式签署,不涉及赔偿事宜。
国际药讯
1.瑞百安获批用于儿科降脂。FDA批准安进依洛尤单抗(瑞百安 、Repatha)用于治疗10岁及以上杂合子家族性高胆固醇血症 (HeFH) 的儿科患者,作为饮食和其他低密度脂蛋白胆固醇 (LDL-C) 降低疗法的辅助治疗。在一项IIIb期临床HAUSER-RCT中,与安慰剂相比,Repatha使患者的LDL-C从基线降低38%(95% CI:45%、31%;p<0.0001);并改善患者的继发性脂质参数。2020年Repatha的销售额为8.87亿美元。
2.艾伯维治疗偏头痛新药获批上市。FDA批准艾伯维CGRP拮抗剂Qulipta(atogepant)用于预防性治疗发作性偏头痛成人患者。此次获批包括10毫克、30毫克和60毫克三种剂量,预计10月上旬上市。在偏头痛治疗领域,艾伯维此前已有两款产品获批上市,一款为针对成人慢性偏头痛的预防性药物Botox肉毒杆菌毒素;另一款为用于成人偏头痛(有或无先兆)的急性治疗口服CGRP受体拮抗剂Ubrelvy。
3.长效HIV预防疗法获FDA优先审评。ViiV Healthcare公司整合酶抑制剂卡博特韦(cabotegravir)获FDA优先审评资格,用于HIV的暴露前预防(PrEP)。如果获批,卡博特韦将成为首个在HIV阴性人群中,降低HIV感染风险的长效PrEP疗法。PDUFA日期为明年1月份。在两项Ⅲ期临床中,卡博特韦与活性对照组相比,分别将防止HIV感染的效果提高89%和66%。
4.放射性配体疗法获FDA优先审评。FDA受理诺华靶向放射性配体疗法177Lu-PSMA-617的新药申请(NDA)并授予其优先审评资格,用于治疗转移性去势抵抗性前列腺癌(mCRPC)经治患者。在一项关键性Ⅲ期临床中,177Lu-PSMA-617联合标准治疗将患者中位总生存期延长了4个月,死亡风险降低38%(HR=0.62, 95% CI:0.52,0.74),患者出现放射学疾病进展或死亡的风险降低60%(HR=0.40,99.2% CI:0.29,0.57)。预计FDA将于明年上半年做出回复。
5.Libtayo获FDA优先审评资格。FDA授予再生元(Regeneron)与赛诺菲开发的PD-1抑制剂Libtayo(cemiplimab)的补充生物制品许可申请(sBLA)优先审评资格,用于治疗经治的复发/转移性宫颈癌患者。在一项Ⅲ期临床中,与化疗相比,Libtayo显著改善了患者的总生存期(OS),两组的中位OS分别为12个月和8.5个月(HR=0.69,p<0.001)。FDA预计在2022年1月30日前做出回复。
6.创新减肥疗法Ⅰ期临床积极。Altimmune制药公司GLP-1/胰高血糖素双重受体激动剂新药pemvidutide(ALT-801)治疗肥胖症的Ⅰ期临床结果积极。接受剂量为1.2 mg,1.8 mg,和2.4 mg的pemvidutide治疗的患者在第12周时体重平均降低4.9%,10.3%和9.0%,而安慰剂组平均体重降低1.6%;其中1.8 mg pemvidutid组中有55%的患者体重降低超过10%。该公司计划尽快启动pemvidutide治疗肥胖症的Ⅱ期临床。
7.聚合酶θ抑制剂上临床。Artios公司高选择性DNA聚合酶θ(Polθ)抑制剂ART4215,在Ⅰ/Ⅱa期临床中完成首例患者给药。该项临床试验将评估口服ART4215作为单药,或与其他抗癌药物联用,在晚期或转移性实体瘤患者中的安全性、耐受性、药代动力学和临床活性,计划入组206例患者,预计2022年获得中期安全性和耐受性数据。据悉,这是首个进入临床开发的特异性Polθ抑制剂。
医药热点
1.国务院发文增强宫颈癌和乳腺癌综合防治能力。国务院日前印发《中国妇女发展纲要(2021-2030年)》指出,要不断增强宫颈癌和乳腺癌综合防治能力。适龄妇女宫颈癌人群筛查率达到70%以上,并逐步提高乳腺癌人群筛查率。加强宫颈癌和乳腺癌筛查和诊断技术创新应用,强化筛查和后续诊治服务的衔接,促进早诊早治,宫颈癌患者治疗率达到90%以上。
2.10省区研讨中药配方颗粒标准互认。中药配方颗粒省级标准互认研讨会在甘肃省陇西县举行,甘肃省、广东省、山东省、浙江省、陕西省、江西省、广西壮族自治区、吉林省、青海省、新疆维吾尔自治区10省(区)药监局和企业代表初步达成共识,将加快建立省级标准共建共享工作机制,制定中药配方颗粒省级标准互认指南,加快推进中药配方颗粒省级标准建设和互认工作。
3.挪威将新冠风险与普通流感等同。挪威公共卫生研究所(FHI)发布最新评估报告,将新冠肺炎归类为风险等同普通流感的呼吸道疾病。FHI认为,尽管新冠病毒仍持续传播,由于病毒突变频繁,使其危险性降低;接种者仍可能感染病毒和出现症状,但是大部分为轻微的流感症状。挪威目前已实现了自然与疫苗诱导的免疫增强,疫情也不再对其医疗系统造成沉重负担。
评审动态
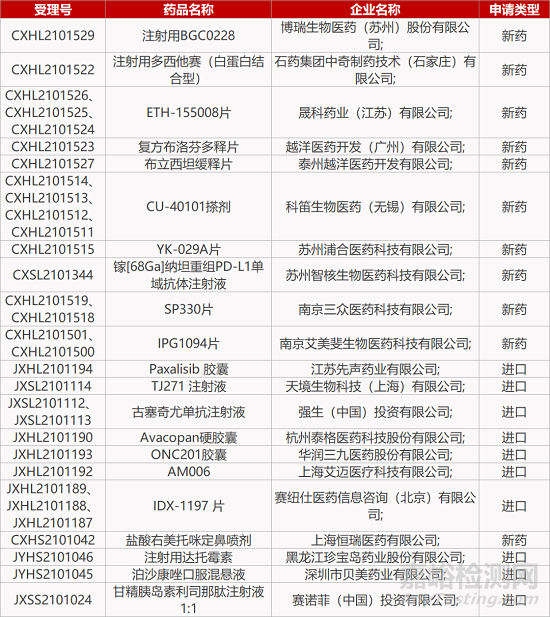
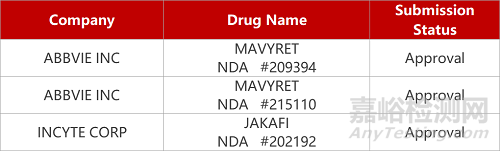

来源:药研发