您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-10-09 15:12
样本量估算是医疗器械临床试验中极为重要的环节,直接关系到研究结论能否达到预期。尽管数理统计学表明样本量越大,样本统计量就越贴近相应的总体参数,但是过大的样本量会降低研究的可行性和增加质控的难度,而样本量过小又难以保证估计精度和检验效能。因此,样本量估算是一个成本-效益和检验效能的权衡过程。
所谓样本量估算,是指为满足统计的准确性和可靠性(I类操作的控制和检验效能的保证)而计算出的所需样本量。那么,临床试验中为什么需要进行样本量的估算呢?
样本量一般以临床试验的主要评价指标进行估算。需在临床试验方案中说明样本量估算的相关要素及其确定依据、样本量的具体计算方法。一般而言,开展一项临床试验,首先应明确试验目的,根据不同的试验目的,进而确定合适的试验设计类型、对照形式、比较类型,同时选取恰当的主要评价指标及其相应参数,以及有临床意义的界值,在假定的I类错误和II类错误下,采用相应的样本量估算公式,可估算出试验所需的样本量。
医疗器械临床试验中,常见的设计类型为平行设计,根据对照的不同,比较类型可按非劣效和优效设计,主要评价指标的类型(定性指标或定量指标)不同,可有不同的计算公式。下面针对医疗器械临床试验中常见的样本量估算作一简单介绍。
01平行设计定量指标样本量计算公式
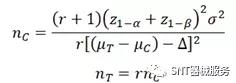
式中,n_T和n_C分别为试验组和对照组所需样本量,r为试验组与对照组的组间比例,通常取1:1;z_(1-α)、z_(1-β)为标准正态分布的分数位,一般取I类错误α为单侧0.025,II类错误β为不大于0.2,此时(z_(1-β)+z_(1-α))^2=(1.960+0.842)^2=7.85;μ_T和μ_C分别为试验组和对照组主要评价指标的均值,σ为总体标准差;∆为有临床意义的界值,如果主要评价指标为高优指标(数值越大越好),则非劣效设计时,∆应为负值,优效设计时,∆应为0或正值。如果主要评价指标为低优指标(数值越小越好),则∆取值正好相反。
02平行设计定性指标样本量计算公式
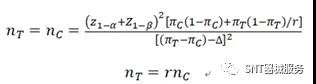
式中,n_T、 n_C、 r、z_(1-α)和z_(1-β)的含义与定量指标计算公式相同;π_T和π_C分别为试验组和对照组主要评价指标的发生率;∆为有临床意义的界值,如果主要评价指标为高优指标,则非劣效设计时,∆应为负值,优效设计时,∆应为0%或正值。如果主要评价指标为低优指标,则∆取值正好相反。
示例:某器械产品临床试验,拟采用非劣效设计,与已上市产品进行对照。根据文献报道,对照器械有效率为90%,在试验中,预期试验器械有效率可达到对照器械同样水平,如果试验器械的有效率比对照器械最多差10%可以接受,假设单侧检验水准为0.025,把握度80%,需多大样本量得到试验器械非劣于对照器械的结论?
计算过程:n_T=n_C=□((7.85×[0.9(1-0.9)+0.9(1-0.9) ])/(0.9-0.9--(-0.1) )^2 )≈142,两组所需有效样本例数分别为142例,考虑试验过程中20%的脱落率,两组分别需招募178例受试者,最终整个试验所需总样本量为356例。
03其他的设计类型
除了以上两种常见的样本量估算形式,器械临床试验中,还有一些其他的设计类型,如单组目标值设计,其样本量计算公式为:n=□([Z_(1-α⁄2) √(π_O (1-π_O ))+Z_(1-β) √(π_T (1-π_T ) )]^2/(π_T-π_O )^2 ),式中π_T为试验组预期事件发生率、π_O为目标值。或是按照医疗器械管理的体外诊断试剂临床试验中,可按如下公式:n=□((Z_(1-α⁄2)^2 π(1-π))/∆^2 )分别计算试验过程中所需的阳性受试者和阴性受试者例数,式中π为灵敏度或特异度的预期值,∆为π的允许误差大小,一般取π的95%置信区间宽度的一半,常用的取值为0.05-0.10。

来源:SNT器械服务


