您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-10-29 23:14
摘要 目的:建立肌苷注射剂杂质分析方法,评价处方工艺合理性。方法:采用高效液相色谱法,色谱柱为Agilent TC C18-2(4.6mm×250mm, 5μm),以甲醇-水(5∶95)为流动相,流速1.0 mL·min-1,柱温30 ℃;检测波长248 nm(5-羟甲基糠醛检测波长280 nm),进样量10 μL;通过破坏实验、原料及四种肌苷注射剂共计18批次样品杂质的测定,分析肌苷原料和注射剂杂质的来源。结果:肌苷原料的工艺杂质为鸟苷、次黄嘌呤和腺苷,注射剂中主要降解杂质为次黄嘌呤,5-羟甲基糠醛为肌苷葡萄糖注射液中葡萄糖的降解产物;肌苷及各已知杂质之间分离度良好。结论:现行质量标准应增加已知杂质及其他单个杂质的控制,由于处方及工艺合理性存在问题,肌苷注射液与肌苷葡萄糖注射液两种剂型安全性存在一定风险。
关键词:肌苷注射液;注射用肌苷;肌苷氯化钠注射液;肌苷葡萄糖注射液;杂质;剂型合理性
Impurity analysis of inosine injection and discussion on rationality of their formulations and processes
KAN Weina, WANG Ji,YANG Hongwei
(Liaoning Institute for Drug Control, Shenyang 110036,China)
Abstract Objective: To establish an impurity analysis method for inosine injections and evaluate the rationality of formulations and processes. Methods: HPLC separation was carried out in an Agilent TC C18-2 column (4.6 mm×250 mm,5μm) under the isocratic elution of methanol-water (5∶95). The flow rate was 1.0 mL·min-1and the column temperature was 30 ℃. The detection wavelength was 248nm(280nm for 5-hydroxymethyl furfural) and the injection volume was 10 μL. The sources of impurities of drug substance of Inosine and Inosine Injections were analyzed by the degradation test and the impurities determination of 18 batches of drug substance of inosine and four kinds of Inosine Injections. Results: Guanosine,hypoxanthine and adenosine were identified as the process impurities of Inosine. Hypoxanthine was the main degradation impurity in Inosine Injections,5-hydroxymethyl furfural was the degradation product of glucosein Inosine Glucose Injection. The resolutions between inosine and the known impurities peaks were good. Conclusion: The known impurities and other individual impurity should be controlled in the specifications. Due to the problems of rationality of formulations and processes,Inosine Injection and Inosine Glucose Injection have certain safety risks.
Keywords:inosine injection; inosine for injection; inosine sodium chloride injection; inosine glucose injection; impurity; rationality of dosage form
肌苷为细胞代谢改善类药物[1],用于治疗心脏病、肝病、白血球减少症、血小板减小症、视神经萎缩、中心视网膜炎,能预防及解除由血防药物引起的对心脏或肝脏的副作用[2]。
肌苷制剂分为口服制剂和注射剂[1],其中《中华人民共和国药典》(简称《中国药典》)收载的注射剂包括肌苷注射液、注射用肌苷、肌苷氯化钠注射液和肌苷葡萄糖注射液不易口服给药的患,注射剂具有药效迅速,作用可靠等优势,尤其适用于不易口服给药的患者。但由于注射剂特殊的使用途径,导致其毒副作用显著,因此对于处方工艺、生产包装以及产品质量都有更高的要求。
本文参考文献[1],调整流动相组成,使肌苷及已知杂质与相邻峰得到良好分离,建立肌苷注射剂杂质的分析方法,并通过对四种注射剂杂质的分析,结合产品的处方及生产工艺,探讨四种注射剂剂型及处方工艺的合理性。
1 仪器与试药
1.1 仪器
岛津LC-20A高效液相色谱仪,Aglient 1200高效液相色谱仪;pH计,电子天平(MettlerToledo)。
1.2 试剂试药
鸟苷对照品(批号:111977-201501),次黄嘌呤对照品(批号140661-200903),腺苷(批号110879-201703),5-羟甲基糠醛(批号111626-201912)均来自于中国食品药品检定研究院。甲醇为色谱纯,实验用水为纯化水。
1.3 样品信息
肌苷原料(A厂家:批号17115134);肌苷注射液(规格2mL:0.1 g)(B厂家:批号180101273;C厂家:批号171003;D厂家:批号1801030;E厂家:批号1612061A;F厂家:批号18040129;G厂家:批号180516001B);注用肌苷(H厂家:规格0.2g,批号17120105;规格0.5 g,批号18030405;规格0.6 g,批号17060204;I厂家:规格0.2g,批号11804022;规格0.4 g,批号1180301;规格0.6 g,批号1180101);肌苷氯化钠注射液(J厂家:规格100mL:肌苷0.6 g与氯化钠0.9g,批号180528041;K厂家:规格250mL:肌苷0.5 g与氯化钠2.25 g,批号K18012701;L厂家:规格100mL:肌苷0.5 g与氯化钠0.9 g,批号1805132331;M厂家:规格100mL:肌苷0.6 g与氯化钠0.9 g,批号3A18041005);肌苷葡萄糖注射液(N厂家:规格100mL:肌苷0.6 g与葡萄糖5.0 g,批号20180402,20180601)。
2 方法与结果
2.1 色谱条件
色谱柱为Agilent TC C18-2(4.6 mm×250 mm,5 μm);流动相为甲醇-水(5∶95);流速为1.0 mL·min-1,柱温为30 ℃;检测波长为248 nm(5-羟甲基糠醛检测波长为280 nm)。进样量为10 μL。
2.2 系统适用性试验
取次黄嘌呤、鸟苷对照品适量,精密称定,分别加水制成每1 mL约含0.2 mg的溶液,作为对照品储备液。取肌苷对照品适量,精密加入一定量的次黄嘌呤和鸟苷对照品储备液,加水溶解并稀释制成含肌苷0.5 mg·mL-1、次黄嘌呤1 μg·mL-1和鸟苷2.5 μg·mL-1的溶液。依法测定,色谱图见图1。肌苷峰与鸟苷峰的分离度应大于3.0,肌苷峰与相邻杂质峰的分离度应大于1.5,理论板数按肌苷峰计不低于2 000。
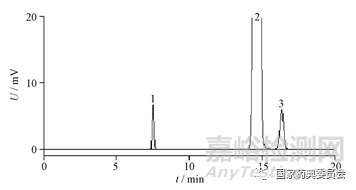
1.次黄嘌呤(hypoxanthine) 2. 肌苷(inosine) 3. 鸟苷(guanosine)
图1 肌苷有关物质测定系统适用性色谱图
Fig.1 HPLC chromatogram of system suitability for related substances of inosine
2.3 溶液的配制
2.3.1 对照品溶液
取次黄嘌呤、鸟苷、腺苷和5-羟甲基糠醛对照品适量,精密称定,加水溶解并稀释制成每1 mL约含次黄嘌呤1μg·mL-1、鸟苷2.5μg·mL-1、腺苷1 μg·mL-1和5-羟甲基糠醛1μg·mL-1的溶液,作为混合对照品溶液,依法测定。
2.3.2 供试品溶液
精密量取样品适量,加水稀释制成含肌苷0.5 μg·mL-1的溶液,依法测定。
2.4 专属性试验
2.4.1 辅料干扰 试验合肌苷氯化钠注射液、肌苷注射液、注射用肌苷和肌苷葡萄糖注射液供样企业提供的处方,按最大使用量配制,制成混合辅料溶液。典型色谱图见图2。结果显示辅料对肌苷及次黄嘌呤、鸟苷、腺苷和5-羟甲基糠醛的测定不存在干扰。
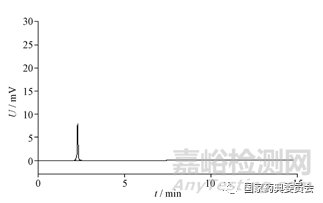
图2 混合辅料溶液高效液相色谱图
Fig.2 HPLC chromatogram of mixed excipients solution
2.4.2 强制降解试验
热破坏:称取肌苷原料适量,置190 ℃,加热30 min,加水溶解稀释制成肌苷浓度约为2 mg·mL-1的溶液,依法测定,记录色谱图。
强酸破坏:称取肌苷原料适量,加0.1 mol·L-1盐酸2 mL,100℃水浴30 min,放冷,加0.1 mol·L-1氢氧化钠2 mL,加水稀释制成肌苷浓度约为2 mg·mL-1的溶液,依法测定,记录色谱图。
强碱破坏:称取肌苷原料适量,加0.1 mol·L-1氢氧化钠2 mL,100℃水浴30 min,放冷,加0.1 mol·L-1盐酸2 mL,加水稀释制成肌苷浓度约为2 mg·mL-1的溶液,依法测定,记录色谱图。
氧化破坏:称取肌苷原料适量,加3%过氧化氢5mL,室温放置30 min,加水稀释制成肌苷浓度约为2 mg·mL-1的溶液,依法测定,记录色谱图。
光照破坏:称取肌苷原料适量,置照度4600Lx光源下,光照24 h,加水溶解稀释制成肌苷浓度约为2 mg·mL-1的溶液,依法测定,记录色谱图。
结果显示(如图3),在上述条件下破坏产生的降解产物均能与主峰分离,专属性良好。热破坏降解产物较多,主要为次黄嘌呤,还有其他未知杂质;强酸破坏主要降解产物为次黄嘌呤;强碱破坏产生多种未知杂质峰,但响应值较低;氧化及光照破坏无明显降解产物产生。
2.5 线性关系试验
取肌苷、次黄嘌呤、鸟苷、腺苷和5-羟甲基糠醛对照品适量,精密称定,分别加水制成每1mL约含0.2mg的溶液,作为对照品储备液。分别精密量取一定量,加水稀释制成含肌苷、次黄嘌呤、鸟苷、腺苷、5-羟甲基糠醛系列浓度的混合对照溶液,作为线性溶液,依法测定,记录色谱图,以浓度为横坐标,以峰面积为纵坐标,绘制标准曲线,记录回归方程及相关系数,结果见表1。
2.6 定量限和检出限
取次黄嘌呤、鸟苷、腺苷和5-羟甲基糠醛的对照品储备液,分别精密量取一定量,加水稀释制成含次黄嘌呤、鸟苷、腺苷5-羟甲基糠醛的混合对照溶液,并加水逐级稀释,并依法测定。以S/N>10计,次黄嘌呤、鸟苷、腺苷和5-羟甲基糠醛的定量限分别为0.015 6 μg·mL-1、0.054 1 μg·mL-1、0.069 6 μg·mL-1和0.064 1 μg·mL-1。以S/N>3计,次黄嘌呤、鸟苷、腺苷和5-羟甲基糠醛的最低检出限分别为0.003 9 μg·mL-1、0.013 5 μg·mL-1、0.017 4 μg·mL-1和0.016 0 μg·mL-1。
2.7 有关物质的测定
按“2.3”项方法制备溶液,依法测定,其中肌苷葡萄糖注射液同时在248 nm与280 nm的双波长下测定。4种肌苷注射剂有关物质典型色谱图见图3。次黄嘌呤等4种已知杂质采用外标法,以相当于肌苷标示量的百分含量计,最大未知杂质含量及其他杂质之和采用面积归一化法计。13个生产企业18批次4种肌苷注射剂有关物质测定结果见表2。
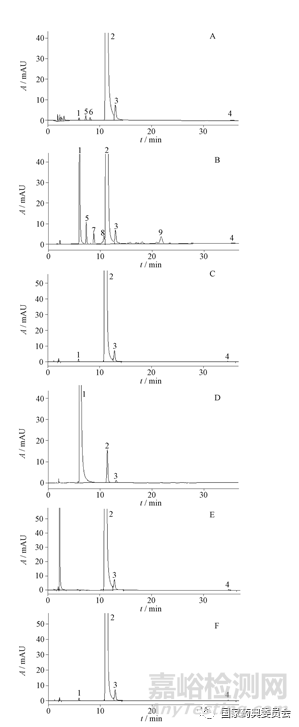
A.碱破坏(alkalihy drolysis) B.酸破坏(acid hydrolysis) C.光破坏(photolysis) D.热破坏(heathy drolysis) E.氧化破坏(oxidation) F.原液(stock solution) 1.次黄嘌呤(hypoxanthine) 2.肌苷(inosine) 3.鸟苷(guanosine) 4.腺苷(adenosine) 5~8.未知杂质(unknown impurities)
图3 肌苷原料强制降解试验色谱图
Fig.3 HPLC chromatograms of forced degradation solution of inosine
3 讨论
肌苷是经枯草芽孢杆菌发酵得到的核苷类化合物。鸟苷与腺苷同为肌苷工艺杂质,亦是枯草杆菌发酵的产物,由于结构与肌苷较为相似,纯化过程难以完全去除;次黄嘌呤是工艺杂质也是降解杂质,它既是枯草杆菌发酵过程中的代谢产物,也是肌苷主要的水解产物;5-羟甲基糠醛是含糖物质在加热过程中产生的,对眼睛、上呼吸道、皮肤和黏膜等有刺激性,对人体横纹肌及内脏有损害,具有神经毒性,能与人体蛋白质结合产生蓄积中毒[3-4],是肌苷葡萄糖注射液需要控制的杂质之一。
4种肌苷注射剂中,肌苷注射液未知杂质的杂质数量最多及含量最高,肌苷葡萄糖注射液中,已知杂质次黄嘌呤含量最高,肌苷氯化钠注射液中已知杂质鸟苷的含量最高,注射用肌苷中已知杂质和总杂的含量最低,杂质数量最少。
鸟苷和腺苷为工艺杂质,其含量间接反映肌苷原料的质量,与制剂处方及工艺过程关联较小。肌苷注射液中检出的杂质除次黄嘌呤、鸟苷及腺苷外,其他未知杂质多达7个,其他杂质总量最高达1.0%,考虑是由于肌苷注射液本身肌苷含量较高(50 mg·mL-1),标准提高调研资料显示,其制备工艺为肌苷加热溶解于氢氧化钠溶液中,由于肌苷溶液在加热及强碱条件下不稳定,容易发生降解,未知杂质多为碱加热降解的产物,这些未知杂质是否具有毒性还需要进一步的确认。5-羟甲基糠醛是葡萄糖单糖化合物在高温或弱酸环境等条件下脱水产生的一种醛类化合物,当pH值偏低或受热温度过高,葡萄糖易转变为5-羟甲基糠醛,若pH偏高,葡萄糖引起差向异构化,生成果糖,受热生成5-羟甲基糠醛的速度更快,所以,葡萄糖为载体的注射剂pH值均控制在弱酸性[5]。《中国药典》2015年版肌苷葡萄糖注射液要求控制pH值在4.0~6.0,而肌苷作为碱性药物,溶液在偏碱性条件下相对稳定,因此,肌苷葡萄糖注射液中杂质次黄嘌呤的含量远高于其他几种注射剂。
从表2结果可以看出,肌苷氯化钠注射液,由于处方中肌苷含量较低,产品pH值控制在6.0~8.0,肌苷在该条件下相对稳定,杂质较少;注射用肌苷为以甘露醇为骨架的冻干块状物,降解杂质少,质量更加稳定。
综上,肌苷注射液由于工艺的因素,杂质数量与含量显著高于其他几种注射剂型,肌苷葡萄糖注射液由于处方的因素,导致杂质次黄嘌呤的含量显著高于其他几种注射剂型。肌苷注射液和肌苷葡萄糖注射液安全性存在较大风险。现行质量标准中[1],只对肌苷注射剂中的总杂质的限度进行了规定,不足以控制各肌苷注射剂品种的质量,从注射剂的特殊性考虑,有必要对已知杂质及其他未知杂质从严控制。生产企业也应该从产品的原料、处方和工艺过程中,分析杂质的来源,优选原辅料,合理设计处方及工艺从而更好地控制产品的质量。
参考文献
[1] 中华人民共和国药典2015年版.二部[S]. 2015:378
ChP 2015. Vol Ⅱ[S]. 2015:378
[2] 王剑,刘永琼,邹莹,等. 肌苷口服液杂质分析及肌苷溶液的稳定性研究[J]. 中国生化药物杂志,2007,28(4):269
WANG J, LIU YQ, ZOU Y, et al. Analysis of impurity in inosine or alsolution and investigation of stability of inosine liquor[J]. Chin J Biochem Pharm, 2007, 28(4):269
[3] 刘冰滢,穆矛,邓锋,等. HPLC法测定果糖二磷酸钠注射液中5-羟甲基糠醛[J]. 今日药学,2020,30(3):176
LIU BY, MU M, DENG F, et al. Determination of 5-Hydroxymethyl furfural infructose sodium diphosphate injections by HPLC[J]. Pharm Today, 2020, 30(3):176
[4] 韩宇,高莹莹,金立弟,等.大株红景天注射液中5-羟甲基糠醛的限量研究[J]. 中国药品标准,2020,21(3):265
HAN Y, GAO YY, JIN LD, et al. Investigation on the limit of 5-HMF in Dazhu Hongjingtian Injection[J]. Drug Stand China, 2020, 21(3):265
[5] 张文,马岩,郭宁宁,等. 葡萄糖输液中间品pH对成品中葡萄糖、PH稳定性及5-HMF量的影响[J]. 中国药学杂志,1995,30(2):90
ZHANG W, MA Y, GUO NN, et al. Influence of intermediate pH of glucose injection on glucose content, pH and 5-hydroxymethyl furfural content of final product[J]. Chin Pharm J, 1995, 30(2):90
阚微娜,王棘,杨宏伟
(辽宁省药品检验检测院,沈阳 110036)

来源:Internet


