您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-11-08 12:09
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
成都惠泰抗肺纤维化新药获批临床。成都惠泰生物1类新药HTPEP-001获国家药监局临床试验默示许可,拟开发用于治疗进行性纤维化性间质性肺疾病(PF-ILD),包括特发性肺纤维化(IPF)、结缔组织病相关间质性肺疾病(CTD-ILD)。HTPEP-001通过竞争性抑制TSP-1和CD36相互作用,来阻断TGF-β上游通路中的活性TGF-β1的释放,从而抑制下游促纤维化因子表达、成纤维细胞增殖、肌成纤维细胞分化、胞外基质过度分泌及异常沉积等关键促纤维化事件的发生。
国内药讯
1.百悦泽治疗CLL的Ⅲ期临床积极。百济神州自主研发的BTK抑制剂百悦泽(泽布替尼,Brukinsa),在一线治疗慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)的Ⅲ期临床中达到主要终点。与活性对照组相比,百悦泽显著延长患者的无进展生存期(HR=0.42,p<0.0001)。中位随访为26.2个月时,百悦泽组经IRC评估的ORR达到94.6%(vs85.3%)。安全性数据与已知研究一致。
2.罗氏CD20/3双抗在华启动临床。罗氏CD20/CD3双特异性抗体RO7030816在中国登记启动一项Ⅰ期临床,旨在复发或难治性滤泡性淋巴瘤患者中评估RO7030816单药治疗的药代动力学、安全性和有效性。计划招募15例患者,由复旦大学附属肿瘤医院曹军宁医学博士担任主要研究者。RO7030816的一端能够与B细胞表面的CD20抗原结合,另一端与T细胞表面的CD3受体结合,将T细胞募集到肿瘤细胞附近,激活T细胞杀死肿瘤细胞。
3.济群CDK4/6抑制剂美国PIND获批。济群医药抗乳腺癌新药GP-501胶囊获得FDA批准,同意按照505b(2) 途径申报,并批准豁免临床,在完成BE等效性临床研究后直接提交NDA。GP-501是辉瑞公司重磅药物CDK4/6抑制剂Ibrance的改良型新药,属于注册分类2的创新药。相比Ibrance的游离碱形式,GP-501的溶解性提高,同时具有较低的引湿性和良好的稳定性。
4.上海医药引进新型抗细菌感染产品。上海医药宣布与菲吉乐科签订合作协议,以不超过5,050万美元(除销售提成外)的交易金额获得菲吉乐科抗细菌感染新药ClyO项目在中国大陆、香港与澳门的开发、生产、注册和商业化权利。ClyO是一款处于临床前期、具有新型作用机制的抗葡萄球菌属细菌的噬菌体裂解酶,拟开发用于金葡菌导致的系统性感染适应症。
5.百泽安Q3中国销售7700万美元。百济神州公布2021年第三季度财报,营业总收入为2.064亿美元,产品营收为1.925亿美元,同比增长111%;研发支出为3.519亿美元,去年同期数据为3.491亿美元;净亏损为4.139亿美元,相当于每股亏损0.34美元。产品销售方面,PD-1抗体百泽安(替雷利珠单抗)在中国的销售额总计为7700万美元,同比增长54%;百悦泽(泽布替尼)全球销售额总计6580万美元,同比增长320%。
国际药讯
1.首款口服抗新冠药物获批上市。英国监管机构批准默沙东与Ridgeback公司联合开发的口服核苷类似物molnupiravir(MK-4482/EIDD-2801)上市,用于治疗轻中度新冠患者,商品名为Lagevrio。molnupiravir也是全球首个获批的口服抗新冠病毒疗法。在一项Ⅲ期临床中,与安慰剂相比,molnupiravir将患者住院或死亡风险降低约50%;而且该治疗组在29天观察期内没有受试者死亡(安慰剂组有8例患者死亡);临床中Molnupiravir显示出良好的安全性。
2.辉瑞口服抗新冠药物II/III期临床成功。辉瑞宣布新冠病毒3CL蛋白酶抑制剂口服疗法PAXLOVID(PF-07321332; ritonavir) 在II/III期临床EPIC-HR中获积极结果。在COVID-19症状出现三天内接受治疗的患者中,与安慰剂相比,PAXLOVID可使COVID-19相关的住院或因任何原因死亡的风险降低89%;第28天安慰剂组有7例患者死亡,而PAXLOVID组无死亡。独立数据监测委员会建议提前结束研究。辉瑞计划尽快向FDA递交这些数据,寻求紧急使用授权。
3.英国推荐Namuscla治疗遗传性疾病。英国NICE推荐Lupin公司钠通道拮抗剂Namuscla(mexiletine,美西律)纳入英国医保体系NHS,用于治疗患有非营养不良性肌强直障碍(NDM)的成人患者,改善肌强直症状。NDM是一种影响肌肉的罕见遗传疾病,最常见的症状是肌强直,会严重影响患者的生活质量。据悉,Namuscla是唯一获得英国营销授权治疗这种罕见疾病的产品。
4.法布里病创新基因疗法即将启动Ⅲ期临床。Sangamo Therapeutics公司创新基因疗法isaralgagene civaparvovec(ST-920)治疗法布里病的Ⅰ/Ⅱ期临床获积极结果。前两个剂量队列(0.5^13 vg/kg和1^13 vg/kg)中,所有4例患者均达到高于正常水平2-15倍的α-半乳糖苷酶A (AGA)活性。首例患者的AGA活性水平维持长达1年。ST-920通常耐受良好,无患者发生需要类固醇治疗的肝酶升高。Sangamo计划启动Ⅲ期临床试验。
5.诺华补体抑制剂达到Ⅱ期临床终点。诺华口服因子B抑制剂iptacopan(LNP023)在治疗C3肾小球病(C3G)患者的Ⅱ期临床中获积极结果。在肾脏移植后C3G复发患者队列中,iptacopan显著降低补体C3蛋白在肾脏中的沉积(p=0.0313);在尚未接受肾脏移植的C3G患者队列中,iptacopan治疗使患者的蛋白尿水平与基线相比降低45%(p=0.0003)。目前诺华已启动关键性Ⅲ期临床的患者招募。
6.创新RNAi疗法关键性临床结果积极。Dicerna公司RNAi候选药物nedosiran治疗原发性高草酸尿症(PH)的Ⅱ期临床达到主要终点。与安慰剂相比,nedosiran著性降低PH1亚型患者的尿液中草酸盐排泄(Uox)量;而且nedosiran组患者达到并维持正常、或接近正常Uox的比例显著更高(50%比0%, p=0.0025);nedosiran通常耐受良好。该公司计划在第4季度向FDA递交新药申请(NDA),用于治疗PH1亚型患者。
7.双环肽偶联免疫疗法上临床。Bicycle公司双环肽偶联免疫细胞激动剂BT7480用于实体瘤的Ⅰ/Ⅱ期临床首例患者给药。BT7480是一款潜在“first-in-class”疗法,由3个双环肽偶联而成,一个双环肽与Nectin-4结合,另外两个双环肽与CD137结合。在临床前研究中,BT7480不需持续给药,就可以显著改变肿瘤微环境,激发免疫细胞的浸润,消除动物体内表达Nectin-4的肿瘤。
医药热点
1.上海统筹优化医疗资源布局。上海市发布《上海市医疗机构设置规划(2021—2025年)》提出,将加快优质医疗资源扩容,完善以市级医院为龙头、以区域性医疗中心为主体、以社区卫生服务中心为网底的基本医疗服务体系。根据规划,上海市将新增床位约4万张,配置水平达到每千人口约7.5张。截至2020年末,该市共有各类医疗卫生机构5905家,其中,三级医疗机构57家,二级医疗机构121家,社区卫生服务中心1114家等,核定床位共14.1万张。
2.胰岛素国家集采正式启动。上海阳光药品采购网日前发布《全国药品集中采购文件(胰岛素专项)(GY-YD2021-3)》,启动第六批国家组织药品集采(胰岛素专项)工作。本次药品集采品种为餐时人胰岛素、基础人胰岛素、预混人胰岛素、餐时胰岛素类似物、基础胰岛素类似物、预混胰岛素类似物,共6个采购组。申报材料递交及截止时间:2021年11月26日上午9点-10点;开标时间:2021年11 月26日上午10点。
3.新冠病毒由主人传染宠物案例首现。据One Health杂志近日发表的论文,希望之城转化基因组学研究所(TGen)首次报告了美国首个新冠病毒从主人传染给宠物的案例。在美国亚利桑那州,一个宠物主人、猫和狗都感染了相同的新冠病毒变异株B.1.575。目前对46000多个来亚利桑那州州的阳性样本进行了基因组测序,该州感染这种毒株的有记录的病例不到25例。
评审动态
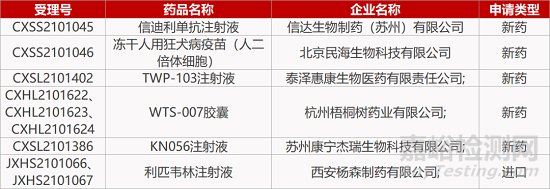
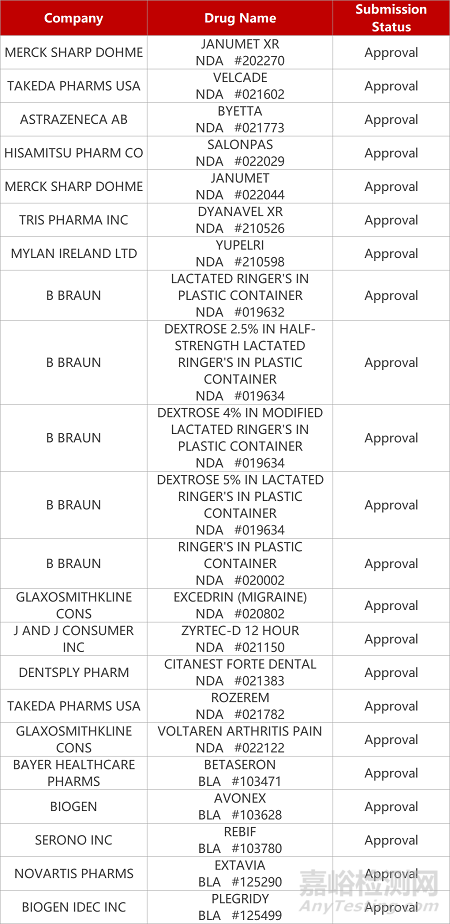

来源:药研发


