您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-11-17 11:13
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
慧宝源抗乙肝新药获批III期临床。慧宝源生物在研新药克来夫定(L-FMAU)获国家药监局批准,将开展一项针对慢性乙型肝炎(HBV)的III期临床研究。L-FMAU是一款人工合成的β-L构型核苷类似物,具有抗病毒和免疫重启双重调节机制。慧宝源生物设计了脉冲给药方式,以期达到患者停药后持续病毒抑制,乃至部分患者达到功能性治愈的目的。
国内药讯
1.特瑞普利单抗治疗食管癌获孤儿药资格。君实生物自主研发的PD-1特瑞普利单抗获FDA授予第四个孤儿药资格,用于治疗食管癌(EC)。此前,FDA已分别授予该新药治疗黏膜黑色素瘤、鼻咽癌及软组织肉瘤的孤儿药资格。在一项III期注册临床JUPITER-06(NCT03829969)中,特瑞普利单抗联合化疗显著改善了EC患者的无进展生存期(PFS)和总生存期(OS)。在中国,NMPA已受理特瑞普利单抗联合化疗一线治疗局部晚期或转移性食管鳞癌的新适应症上市申请。
2.信迪利单抗启动NSCLC国际III期临床。信达生物登记启动一项信迪利单抗联合化疗用于非小细胞肺癌(NSCLC)术前新辅助和术后辅助治疗的国际III期临床ORIENT-99研究。该项研究国内计划入组 640人,国际800人,由上海市肺科医院的周彩存教授担任主要研究者。主要终点为在PD-L1阳性(PD-L1 TC≥1%)人群中由IRRC评估的EFS;在 ITT 人群中由IRRC评估的EFS;在ITT人群中由BIPR评估的pCR率。
3.鑫康合IL-25单抗获批哮喘临床。鑫康合自主研发并具有全球知识产权的IL-25单抗XKH001注射液获国家药监局临床试验默示许可,拟临床用于中重度哮喘的治疗。XKH001可以特异性中和人IL-25,阻断其与受体的结合,进而抑制Th2引起的炎症反应。今年7月,FDA已批准XKH001在美国开展I期临床试验。目前全球同靶点药物均处于临床前开发阶段,XKH001为首个进入临床的IL-25抑制剂。
4.国健呈诺CAR-NK细胞疗法获批临床。国健呈诺生物1类新药靶向间皮素嵌合抗原受体NK细胞注射液获国家药监局临床试验默示许可,拟用于晚期上皮性卵巢癌的治疗。这也是国内获批进入临床的首例“现货型”异体来源的CAR-NK产品。据悉,CAR-NK细胞可快速杀伤肿瘤的活性,且不会产生细胞因子风暴,也不会引起移植物抗宿主病(GvHD),副作用极低。
5.绿叶长效微球制剂LY03009在美报IND。绿叶制药自主研发的微球注射剂LY03009在美国提交I期临床试验申请。LY03009是一款每月用药一次的长效微球注射剂,能够在目标给药间隔期间稳定维持血浆药物水平,具有持续多巴胺能刺激的优势,并延迟治疗中左旋多巴的引入,拟开发用于治疗帕金森病和不宁腿综合征。在澳洲,该新药处于I期临床开发阶段。
国际药讯
1.两款新冠中和抗体获欧盟批准。欧洲药品管理局(EMA)批准再生元和罗氏开发的抗体鸡尾酒疗法Ronapreve(casirivimab/imdevimab)上市,用于治疗12岁以上、不需要补充氧气且疾病恶化风险增加的轻中度COVID-19患者,以及获批用于在青少年和成人中预防COVID-19。EMA近日还批准了韩国Celltrion公司开发的抗体药物Regkirona(regdanvimab)上市,用于治疗不需要补充氧气且疾病恶化风险增加的COVID-19成人患者。
2.创新肿瘤电场疗法Ⅱ期新数据积极。Novocure公司肿瘤电场疗法TTFields联合PD-1抑制剂帕博利珠单抗(Keytruda)和DNA甲基化剂替莫唑胺(temozolomide),在治疗新确诊胶质母细胞瘤(GBM)成人患者的Ⅱ期临床新数据积极。在随访超过9个月的19例患者中,患者的PFS达到至少11.2个月,高于肿瘤治疗电场与emozolomide辅助治疗的历史对照数据(PFS为6.7个月)。并且,6例(24%)患者获得部分或完全缓解。
3.溶瘤病毒/PD-1抗体组合Ⅱ期临床积极。CG Oncology公司溶瘤病毒疗法CG0070联合PD-1抗体Keytruda治疗非肌层浸润性膀胱癌的Ⅱ期临床中期结果积极。100%达到3个月评估点的患者(n=9)获得完全缓解,同时在达到6个月评估点的患者中(n=6),所有患者维持完全缓解,达到9个月评估点的患者完全缓解率仍为100%(n=3)。临床中,未发现3级以上治疗相关不良事件和严重不良事件。乐普生物拥有它在中国的开发权益。
4.Vir两款乙肝功能性治愈疗法临床积极。Vir Biotechnology靶向乙肝病毒(HBV)的X基因的RNAi疗法VIR-2218,在治疗慢性HBV的临床中获积极结果。VIR-2218单药或与聚乙二醇化干扰素α(PEG-IFN-α)联用,均显著降低患者的HBsAg水平(平均>2 log10 IU/mL)。联合治疗组HBsAg降幅更大,95%(n=21/22)HBsAg水平<100 IU/mL,55%(n=12/22)HBsAg水平<10 IU/mL。另一款HBV中和抗体VIR-3434也在Ⅰ期临床中取得积极结果,在75 mg队列中观察到最大幅度(> 2 log10 IU/mL)和最持久的HBsAg下降,没有报告新的安全信号。
5.VEGF靶点眼科新药早期临床积极。EyePoint公司玻璃体内注射用抗VEGF品种EYP-1901治疗湿性年龄相关性黄斑变性(AMD)的Ⅰ期临床DAVIO结果积极。单次注射 EYP-1901后,分别有76%和53%的患者在4个月和6个月内无需抢救;患者第六个月时实现稳定的最佳矫正视力 (BCVA),-2.5 个字母和中心子视野厚度 (CST),-2.7 μm,而且整体治疗负担减少了79%;临床中,没有剂量限制性毒性,没有眼部严重不良事件 (SAE)。
6.Recludix拟加速开发SH2抑制剂。Recludix Pharma公司宣布完成6000万美元的A轮融资。Recludix的专有技术平台能针对SH2结构域蛋白靶标,开发强效、选择性的创新口服抑制剂。Recludix目前聚焦于STAT蛋白方向,STAT异常激活见于多发性白血病、淋巴瘤和实体瘤,以及炎症性疾病等。此轮融资将用于支持该公司靶向STAT3、STAT6、和一个未公开非STAT靶标的SH2结构域抑制剂项目。
医药热点
1.烟台毓璜顶医院成功备案两项干细胞临床研究。近日,山东省烟台毓璜顶医院的两个干细胞临床研究项目一次性通过省级和国家级评审,在国家卫健委成功备案。两个项目分别为“人脐带间充质干细胞注射液治疗中-重度持续性变应性鼻炎的临床研究”、“脐带间充质干细胞静脉输注治疗酒精性失代偿期肝硬化的安全性、耐受性及初步有效性临床研究”。据悉,此次全国共有11个干细胞临床研究项目在国家卫健委备案成功。
2.武汉开工新建一家三甲公立医院。11月12日,武汉东湖高新区首家区属公立医院光谷人民医院(中南医院光谷院区)正式开工建设。光谷人民医院位于花山生态新城,建筑面积约24万平方米,将按照三级甲等标准,建设床位1000张的国际化医疗保健服务基地,预计2024年建成投用,并由武汉大学中南医院运营管理。
3.福建出台方案加快全科医生培养。福建省日前印发《福建省全科医生培训实施方案》指出,力争在2025年前实现基层医疗卫生机构注册或增加注册全科医学专业的执业(助理)医师数占机构临床、中医类别执业(助理)医师数的比例达到90%,并纳入各级相关部门绩效考核指标体系。在统筹使用中央补助资金的基础上,省级财政将对全科专业住院医师规范化培训、助理全科医生培训分别按每人每年4.8万元、3.6万元标准给予补助。
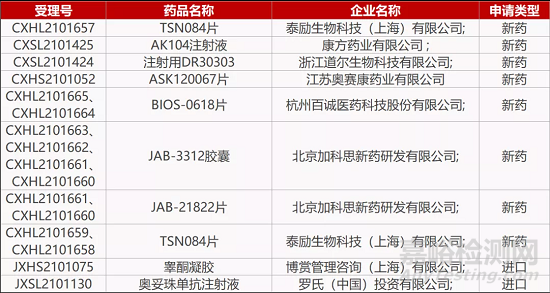
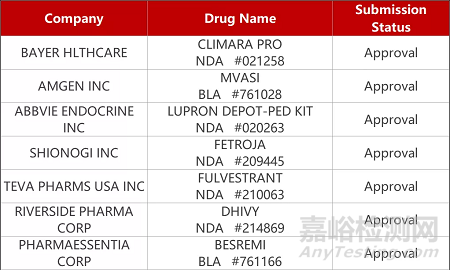
评审动态

来源:药研发


