您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-11-19 09:19
本文主要介绍了成都欧赛医疗器械有限公司研发的创新医疗器械“中空纤维膜血液透析滤过器”的临床前研发实验。
一、中空纤维膜血液透析滤过器的产品结构及组成
该产品由聚醚砜中空纤维膜、壳体、端盖、密封圈和封口胶组成,其中中空纤维膜采用聚醚砜纺制而成作为血液透 析滤过的半透膜,利用聚氨酯将中空纤维膜固定在外壳内。与血液透析滤过设备、透析管路和透析液、置换液配套使用。
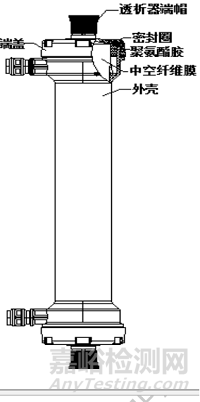
图 1 透析滤过器示意图
二、中空纤维膜血液透析滤过器的产品适用范围
该本产品适用于抢救和/或治疗各种原因引起的急、慢性肾衰竭的患者的血液透析滤过治疗。
三、中空纤维膜血液透析滤过器的型号/规格
OCI-HF160、OCI-HF170、OCI-HF180、OCI-HF200
四、中空纤维膜血液透析滤过器的工作原理
血液透析滤过器的中空纤维膜为半透膜,血液与透析液分别流经膜的两侧,利用透析膜两侧的静水压和渗透压梯度差而进行跨膜转运,使血液中的中大分子毒素、水分和小分子毒素,从高浓度的血液一侧通过半透膜向低浓度的透析液一侧转移,从而达到净化血液的效果。
五、中空纤维膜血液透析滤过器的产品技术要求研究项目
5.1 外观
5.2 规格尺寸
有效膜面积
血室容量
尺寸(血室、置换液出入口)
5.3 机械性能
结构密合性
血室密合性
血室接口
置换液接口
5.4 物理性能
微粒
适应温度范围试验
5.5 化学性能
还原物质
金属离子
酸碱度
蒸发残渣
紫外吸光度
溶剂残留量
5.6 生物性能
无菌
热原
5.7 使用性能
膜性能指标
膜的孔隙率
超滤率
清除率
筛选系数
压力降
5.8 有效期
六、中空纤维膜血液透析滤过器的产品性能评价研究
产品经广州医疗器械质量监督检验中心检测,结果表明产品符合设计输入要求。
七、中空纤维膜血液透析滤过器的生物相容性研究
根据产品工作原理、预期用途及 GB/T16886.1-2011 中 5.3 规定,本产品属于与循环血液短期接触(一般治疗时间为4小时);虽然本品与患者血液短期接触,但患者需要长期通过透析治疗维持生命,因此对于短时间、多次接触的器械考虑潜在的累积作用,因此本产品按照GB/T16886.1-2011中5.3的规定长期接触(B)类,即采用较严的试验来评价本产品。
具体试验项目按照 GB/T16886.1-2011 中附录A中表A.1中循环血液中B来选择对产品的生物评价试验:急性全身毒性、细胞毒性、致敏、皮内刺激、与血液相互作用、亚慢性全身毒性、遗传毒性和植入。产品生物相容性风险可接受。
八、中空纤维膜血液透析滤过器的灭菌研究
该产品采用辐照灭菌,无菌状态提供。成都欧赛医疗器械提供了灭菌过程确认报告,证明无菌保证水平为10-6。
九、中空纤维膜血液透析滤过器的产品有效期和包装研究
该产品有效期三年。成都欧赛医疗器械分别进行了加速老化试验和实时老化试验,对产品稳定性、包装完整性进行验证。
十、中空纤维膜血液透析滤过器的可沥滤物研究
根据该产品所使用原材料中封口胶成分聚氨酯胶中对二苯基甲烷二异氰酸酯(MDI),纺丝过程中 N,N-二甲基乙酰胺(DMAC)的可能残留,生产企业进行了可沥滤物安全性研究。在确定允许限值后对可能残留的物质进行检测,残留量满足要求。

来源:嘉峪检测网


