您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-11-19 11:45
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
AD鼻腔疫苗启动I期临床。天境生物和恩华药业拥有全球开发、生产和商业化许可权的新型鼻腔疫苗(Protollin)即将在美国布莱根医院(BWH)启动Ⅰ期临床,评估用于预防和减缓阿尔茨海默病(AD)进展的疗效。Protollin是哈佛医学院附属医院BWH和Inspirevax公司合作开发的一款由细菌的外膜蛋白和脂多糖(LPS)组成的新型免疫刺激疗法制剂,旨在激活颈部两侧和背部淋巴结中发现的白细胞,以迁移到大脑并触发β淀粉样斑块(阿尔茨海默病的标志之一)的清除。
国内药讯
1.人福「苯磺酸瑞马唑仑」新适应症报产。人福医药1类新药「苯磺酸瑞马唑仑」新适应症的上市申请获CDE受理,推测该项适应症可能为支气管镜诊疗镇静。瑞马唑仑是由 GSK公司设计、Paion AG公司开发一种短效GABAa受体激动剂。由于瑞马唑仑的游离碱不稳定,Paion公司将其开发为瑞马唑仑的苯磺酸盐。2012年,人福药业通过授权获得瑞马唑仑在中国的开发权利。去年7月,该新药已获批上市,用于结直肠镜检查镇静。
2.正大天晴PD-L1/TGFβ双抗启动II期临床。正大天晴在ClinicalTrials.gov登记启动一项II期临床,评估TQB2858联合安罗替尼用于治疗复发或转移性晚期子宫内膜癌。PD-L1/TGFβ是热门的靶点组合,国内至少有12个企业项目进入到临床阶段。国内同类药物开发进展最快的是恒瑞医药的SHR-1701,已进入III期临床阶段,其次为普米斯生物的PM8001,现处于II期阶段。
3.甘莱ASC41治疗NASH上I期临床。歌礼制药子公司甘莱制药THRβ/FXR双靶点复方制剂ASC43F在美国开展的I期临床首例受试者给药。该项试验旨在评估ASC43F在健康受试者中的安全性、耐受性和药代动力学。ASC43F是由5 mg ASC41(甲状腺激素β受体激动剂)和15 mg ASC42(法尼醇X受体激动剂)组成的固定剂量单片复方制剂,拟用于治疗非酒精性脂肪性肝炎(NASH)。
4.杭州百诚镇痛新药报IND。杭州百诚医药BIOS-0618片的临床试验申请获CDE受理。BIOS-0618片是一款具有全新作用机理、靶向组胺H3的创新药,拟用于神经病理性疼痛(NPP)的治疗。NPP病因主要包括神经受压和创伤、代谢性疾病、癌症、感染、自身免疫性疾病和血管病等。百诚医药目前有靶向H3、 CDK4/6、PI3K、PPARα/δ靶点的5款在研药物,BIOS-0618也是该公司首个提交临床申请的1类新药。
5.FDA恢复华海药业原料药进口。华海药业日前收到FDA信函,宣布解除该公司川南原料药生产基地进口禁令。2018年6月,由于在华海缬沙坦原料药中发现并检定出NDMA杂质,FDA同年9月已禁止该公司川南生产基地生产的所有原料药以及其制剂产品出口至美国。禁令解除后,华海药业川南生产基地生产的原料药、使用该基地原料药的制剂产品,且在美国注册批准的均可正常进入至美国市场。
国际药讯
1.辉瑞口服抗新冠药物报EUA。辉瑞宣布已向FDA递交新冠病毒口服药Paxlovid™(PF-07321332+利托那韦)的紧急授权申请(EUA),这是一款3CL蛋白酶抑制剂PF-07321332与低剂量利托那韦(Ritonavir)的复方制剂。该公司同时向英国、澳大利亚、韩国等多个国家滚动提交上市申请;并与一个由联合国支持的名为MPP(Medicines Patent Pool,药品专利池)组织达成一项协议,允许其他公司生产这款COVID-19口服抗病毒治疗药物。
2.IL-23抑制剂获欧盟批准治疗银屑病关节炎。欧盟委员会(EC)批准艾伯维IL-23抑制剂Skyrizi(risankizumab)第二项适应症,单药或联合甲氨蝶呤(MTX),用于治疗对抗风湿药物(DMARDs)应答不足或不耐受的活动性银屑病关节炎成人患者。在两项Ⅲ期临床中,与安慰剂组相比,Skyrizi治疗组第24周时达到ACR20应答的患者比例更高(57.3%vs33.5%,51.3%vs26.5%,p<0.001)。Skyrizi此前已获FDA和欧盟批准治疗银屑病。
3.欧盟批准渤健多发性硬化新药上市。欧盟委员会(EC)批准渤健新型口服富马酸Vumerity上市,用于治疗复发缓解型多发性硬化(RRMS)。Vumerity是渤健已上市药物Tecfidera(富马酸二甲酯)的升级版,具有改善的胃肠道耐受性。在一项评估两药在RRMS患者中的胃肠道(GI)耐受性的Ⅲ期EVOLVE-MS-2研究中,Vumerity组总的治疗中断率低于Tecfidera组(1.6%vs6%),因GI耐受性导致的治疗中断率也较低(0.8%vs4.8%)。
4.JAK1抑制剂治疗UC获欧盟批准。欧盟委员会(EC)批准吉利德与Galapagos NV开发的口服JAK1抑制剂Jyseleca(非戈替尼)新适应症,用于治疗对常规疗法或生物制剂应答不足、失应答或不耐受的中重度活动性溃疡性结肠炎(UC)成人患者。该药此前已在欧盟、英国、日本获批上市,用于治疗抗风湿药物(DMARD)应答不足或不耐受的中重度类风湿性关节炎(RA)成人患者。
5.口服WEE1抑制剂获快速通道资格。Zentalis公司口服WEE1抑制剂ZN-c3获FDA授予快速通道资格,用于治疗复发或持久性子宫浆液性癌。WEE1是一种DNA损伤反应蛋白,抑制它的活性可以导致携带DNA损伤的癌细胞在损伤未修复的情况下进入有丝分裂,促进细胞的死亡。在一项注册性Ⅱ期临床中,截至今年5月,ZN-c3在子宫浆液性癌患者中的客观缓解率达到43%(3/7)。
6.PRMT5抑制剂抗肿瘤报IND。Mirati公司PRMT5/甲硫腺苷(MTA)抑制剂MRTX1719向FDA提交了一项Ⅰ/Ⅱ期临床IND申请,用于治疗甲硫腺苷磷酸化酶(MTAP)缺失的癌症。PRMT5是MTAP突变的合成致死靶点。MTAP基因缺失发生在大约10%的癌症中,包括胰腺癌、肺癌和膀胱癌。在临床前研究中,MRTX1719能够选择性靶向MTAP缺失的癌细胞中必需的PRMT5蛋白,同时不伤害健康的非肿瘤细胞。
7.Aduhelm治疗AD上市申请或遭拒绝。渤健和卫材开发的阿尔茨海默病药物Aduhelm收到欧洲药品管理局人用药品委员会的“负面趋势投票”。欧洲药物审查员们认为不应批准Aduhelm用于治疗阿尔茨海默病,欧洲监管机构预计将在今年12月做出最终裁决。除欧盟市场外,两家公司也在积极寻求在亚洲市场取得突破,日本监管机构今年年底前可能会根据2020年12月提交的文件做出决定。
医药热点
1.新冠病毒正在美国野生动物中传播。据美国有线电视新闻网17日消息,科学家研究发现,新冠病毒正像其他病毒一样,在美国白尾鹿以及其他野生动物中传播扩散。最新公布的一项研究显示,2020年9月至2021年1月期间,在艾奥瓦州测试的白尾鹿群中,有三分之一显示出感染迹象。研究员推测:当地污水中含有新冠病毒,人们随地吐痰或以其他方式污染环境,也可能是导致鹿感染的原因。
2.2021年两院院士增选结果揭晓。11月18日,2021年两院院士增选结果正式揭晓,共有149人当选。中国科学院增选院士65人(平均年龄57.4岁),其中,生命科学和医学学部10人;中国工程院增选院士84人(平均年龄58岁),其中,医药卫生学部11人。此外,中科院新当选外籍院士25人,分别来自11个国家,韩国和瑞士首次有科学家当选中科院外籍院士;中国工程院新当选外籍院士20人。
3.晚睡将增加心血管疾病与猝死风险。发表在《欧洲心脏杂志-数字健康》上的一项最新研究显示,和晚上10点至11点之间入睡相比,午夜后或晚上10点之前入睡会使患心血管疾病的风险增加25%左右,而对于在晚上11-12点之间入睡的人来说,这一风险增加了12%。研究人员认为,最危险的时间是午夜之后入睡,这可能是因为它可能会减少看到晨光的可能性,而晨光会重置生物钟。
评审动态
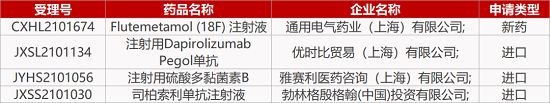
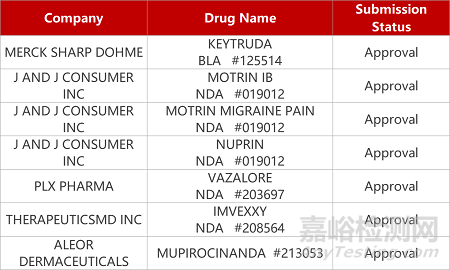
1. CDE新药受理情况(11月19日)

来源:药研发


