您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-02-17 12:29
溶出度:溶出度作为口服固体制剂质量控制的一个重要指标,在评价药品的质量一致性以及变更研究中具有重要意义,尤其对某些品种而言,建立有区分力的溶出曲线是研究中的重点以及难点。在仿制药一致性评价中,通常所说的有区分力的溶出曲线,即该溶出度检查方法能够评估仿制药的处方工艺、获得原研药品的关键特征,比较出仿制药与原研药品体外溶出行为差异、甚至可以作为预测体内行为的重要手段[1]。
固体制剂在胃肠道中的行为特征:虽然不同剂型在胃肠道中具有不同的行为特征(图1是一些常见固体制剂在胃肠道中的行为特征),但固体制剂的主要给药方式是口服,口服后需先溶解,然后才能透过胃肠道黏膜吸收入血液循环。按照生物药剂学分类系统(biopharmaceuticsclassification system,简称BCS分类),药物的理化性质有易溶解和难溶解的区分,生物性质也有易吸收和难吸收的区别,尽管药物的性质千差万别,但在一般情况下,药物在体内的溶出速度是影响药物的起效时间、作用强度和实际疗效的限速因素。
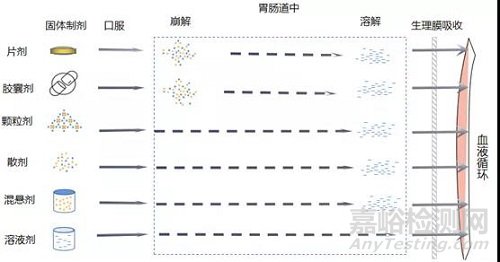
图1 常见固体制剂在胃肠道中的行为特征
片剂和胶囊剂需要先崩解成细颗粒,在崩解的过程中将药物分子溶出,再通过胃肠道黏膜吸收入血液循环系统中。颗粒剂和散剂已经是分散颗粒单元,直接溶解后被吸收。除固体制剂外还有液体制剂如混悬剂,药物在助悬剂的作用下分散,颗粒较小,经过溶解后吸收。溶液剂则不需要溶解,可直接吸收,这也是剂型影响药物起效时间快慢的原因。从药物在体内的行为特征来看,溶出度试验在评价口服固体制剂内在品质中有着举足轻重的作用,国家药品审评中心曾提出“仿产品不是仿标准”的指导思想,可见溶出试验不能奉行“照本宣科”,应该根据产品自身的特性,建立有区分力的溶出曲线,下面将从以下类别分别阐述思路,希望起到抛砖引玉的作用。
(1)普通口服固体制剂:对于普通的口服制剂,参照《普通口服固体制剂溶出度试验指导原则》[2]作为基础,常规的溶出试验条件不需要与胃肠道环境严格保持一致,但应根据药物的理化性质和口服后可能暴露的条件确定适当的介质。
①溶出介质的体积:溶出介质的体积一般为500、900或1000ml,溶出介质的体积满足漏槽条件。
②溶出介质及PH条件:一般采用PH值1.2-6.8的水性介质。介质的PH根据人体胃肠道环境进行设计(见图2),可采用不含酶的PH1.2、6.8的溶出介质作为人工胃液和人工肠液。特殊条件下,可采用高PH的溶出介质,但一般不应超过PH8.0。
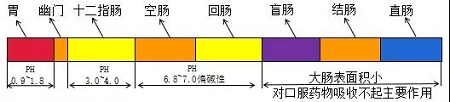
图2:一般情况下胃肠道内PH值
尽量不要采用纯水作为溶出介质,因为水的PH值和表面张力可能根据来源不同而变化,且在试验过程中可能由于药物、辅料的影响而有所改变。另外,对于不溶于水的药物,可以考虑加入一定浓度的表面活性剂,但加入的必要性和合理性需要充分论证,不建议在溶出介质中使用有机溶剂。
③温度和转速:所有普通口服制剂的溶出试验均应在37±0.5℃的条件下进行。溶出度试验过程中应采用较缓和的转速,使溶出方法具有更好的区分力。一般情况下篮法的转速为50-100转/分钟;浆法的转速为50-75转/分钟。
一般仿制药溶出曲线建立思路:可参照参比制剂各标准(如国家进口注册标准、USP及FDA溶出数据库)根据原料的解离常数及药代学参数选择可能的体内吸收部位及可能经过的胃肠道pH值。并参照各国药典、美国溶出方法学数据库、日本橙皮书等拟定选择不同pH值的溶出介质进行溶出曲线考察。基于参比制剂体内药代动力学信息(Tmax)设计溶出曲线截止时间点,选择不同pH溶出介质考察参比制剂在各溶出试验条件下的溶出曲线(转速由低到高、若加表面活性剂,则浓度由低到高),从而获得区分力适宜、具备一定体内外预测力的溶出曲线,进而指导处方工艺研发。
(2)PH依赖性药物制剂:对于PH依赖性药物,通过绘制至少8个点的“PH值-溶解度”曲线,从溶解度趋势图便可判断。若为PH依赖性药物制剂,在一般条件50rpm下,出现如下情形:溶解度高的介质中15min达85%的快速释放和在溶解度低的介质中120min都达不到85%的慢速释放。这两种情形均不能反映药品真实的内在品质,因为过于快速和过于慢速均不具备区分力。此时,可对溶解度急剧变化的pH值段予以细分(±0.5),找到45~60min达85%的pH值介质和90~120min达85%的pH值介质,且溶出曲线应无拐点和突释,这样的两条曲线被认为是既不慢、又不快,最具区分力[3]。
对于PH依赖的药物制剂,可能会存在120min溶出量仍然不到50%的现象,针对释放慢的介质,无需放宽试验参数,最终溶出量未达85%仍可进行仿制制剂与原研制剂的曲线比较,因已有三条曲线达85%、且其中还含有区分力介质,故该介质无需再深入研究。
(3)缓控释制剂:缓控释制剂的设计特点就是服药次数少,药物呈现缓慢释放的特点,除需要反映产品内在品质外,还需要方便检测。一般设定50rpm、并以每天服用次数设定取样时间点,如某药物每天服药1次,则应测定至24h,并在该时间内曲线应呈缓慢上升状,且无突释和拐点。为更全面地进行仿制制剂的开发与品质评价,还应分别比较不同转速下与原研制剂溶出曲线的一致性,如50rpm(呈现24h释放情形)、100rpm(呈现12h释放情形)、200rpm(呈现8h释放情形);且有时在制订质量标准时,为提高溶出检测效率,拟定200rpm、8h释放控制的质量标准也是合理的。如某缓释片,用法用量为一天一片,但质量标准却拟定桨板法/200rpm、7h的取样测定就是基于提高检测效率的考虑[3]。
讨论与总结:有区分力的溶出条件是值得研发人员深思的一点,有时按照质量标准试验条件进行溶出试验,结果得到的往往为快速释放情形,试验条件并不具有区分力。但是也不可否认,体外溶出相似了,并不等于体内生物等效性(BE)等效,而如果体内BE等效了,体外溶出的相似性就显得不那么重要了。基于此,从原研制剂入手进行深度剖析,获取具有区分力的溶出度试验条件和溶出行为或许更具意义。
参考文献:
[1] 关玉晶, 姜建华. 具有区分力的罗红霉素片体外溶出度方法研究[J]. 药物评价研究, 2017, 40(12):4.
[2] 普通口服固体制剂溶出度试验技术指导原则
[3] 药物一致性评价中什么样的溶出曲线具有区分力

来源:药事纵横


