您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-02-23 10:56
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.志健金瑞RET抑制剂获快速通道资格。志健金瑞生物第二代RET抑制剂APS03118获FDA授予快速通道资格,用于对选择性RET抑制剂耐药的转移性RET融合阳性非小细胞肺癌(NSCLC)患者。在临床前研究中,APS03118对导致选择性RET抑制剂耐药的守门员V804M/L/E和溶剂前沿G810R/S/C突变具有更强的抑制效果;在脑转移肿瘤模型中,APS03118也表现出显著的抗肿瘤效果。相关研究结果将在AACR2022年会上公布。
2.信达Claudin18.2靶向CAR-T上临床。信达生物宣布其研发的全球首创通用「模块化」Claudin18.2嵌合抗原受体 T 细胞(CAR-T)注射液IBI345在治疗晚期 Claudin18.2阳性实体瘤的临床试验中完成首例患者给药。这是IBI345的首项研究者发起临床试验(NCT05199519),计划入组30例Claudin18.2阳性、晚期胃癌或胰腺癌患者,以探索IBI345的安全性、耐受性、药代动力学和初步疗效。目前全球范围内尚无靶向Claudin18.2的疗法获批上市。
3.恒瑞1类新药获批慢性咳嗽临床。恒瑞医药1类化药HRS-2261片获国家药监局临床试验默示许可,拟开发用于慢性咳嗽的治疗。慢性咳嗽持续时间≥8周,X线胸片无明显肺疾病证据,以咳嗽为主要或唯一症状。常见病因有上气道咳嗽综合征、咳嗽变异性哮喘、嗜酸粒细胞性支气管炎和胃食管反流性咳嗽等。据估计,全球有5%-10%的成年人患有慢性咳嗽,临床需求庞大。
4.成都赜灵JAK3抑制剂报IND。成都赜灵生物研发的化学1类新药ZL-82片的临床试验申请获CDE受理。ZL-82是一款JAK3高选择性抑制剂,拟用于治疗内风湿性关节炎和炎症性肠病,临床前研究表明ZL-82与相同靶点的上市药物相比,具有优效性。成都赜灵系一家“华西系”生物医药公司,已于去年完成超亿元的A轮融资,用于推进在研新药管线的临床研究。
5.牛痘病毒溶瘤产品在华报IND。恒翼生物与Genelux Corporation共同申报的Olvi-Vec注射液的临床试验申请已获CDE受理。Olvi-Vec是Genelux Corporation从牛痘病毒LIVP菌株中提取得到的非致病性溶瘤痘苗病毒,能够介导肿瘤溶解并触发免疫激活和记忆,以进行长期的癌症免疫治疗。恒翼生物已去年成功引进Olvi-Vec,获得其在大中华区(中国大陆、香港、澳门和台湾)的独家权利。
6.烁星生物完成近亿元A轮融资。北京烁星生物完成近亿元A轮融资。本轮融资由中金资本旗下中金启德基金领投,华金投资、长安私人资本跟投,探针资本担任独家财务顾问。烁星生物由梁延斌博士于2019年创立,致力于纳米多抗研发。此轮资金主要用于该公司开发拟用于血液肿瘤治疗的SM3321等两款抗体在中美两国的临床申报。SM3321特有的结合位点能够强力靶向肿瘤细胞,激活免疫细胞功能,减少非特异性毒性反应。
7.英百瑞完成2.3亿元A轮融资。英百瑞(杭州)生物宣布完成2.3亿人民币A轮融资,推动其First-in-Class现货型同源异体CAR-NK和NK细胞治疗药物进入到临床阶段。本轮融资由瑞享源基金和中南创投基金共同领投,隆门资本、中关村开元资本、东方汇昇、贝鱼百瑞基金等多家投资机构跟投,此前,该公司已获得龙磐基金Pre-A轮8000万元融资,目前累计获得的融资已达到3.1亿。
国际药讯
1.拜耳糖尿病肾病新药在欧盟获批上市。欧盟委员会批准拜耳非甾体选择性盐皮质激素受体拮抗剂非奈利酮(finerenone,Kerendia®)10mg和20mg的上市申请,用于治疗与2型糖尿病相关的慢性肾病(3和4期并伴有白蛋白尿)成人患者。在一项III期临床FIDELIO-DKD研究中,与标准治疗相比,Kerendia将这类患者的肾病进展减缓18%,将心血管风险降低14%。基于这项阳性结果,FDA于去年7月批准非奈利酮上市。
2.阿斯利康/第一三共HER2-ADC Ⅲ期临床积极。阿斯利康与第一三共制药联合开发的HER2-ADC疗法Enhertu(trastuzumab deruxtecan),在治疗HER2低表达、不可切除性和/或转移性乳腺癌的关键Ⅲ期DESTINY-Breast04试验(NCT03734029)中达主要终点。无论激素受体(HR)状态如何,与医生选择的化疗相比,Enhertu治疗使无进展生存期(PFS)和总生存期(OS)取得统计学意义的显著改善。Enhertu的安全性与之前的临床试验一致,没有发现新的安全问题。
3. 强生IL-23抑制剂克罗恩病Ⅱ期临床积极。强生旗下杨森制药在ECCO2022大会上公布IL-23抑制剂Tremfya(古塞库单抗)治疗克罗恩病(CD)的Ⅱ期GALAXI 1临床(NCT03466411;EudraCT 2017-002195-13)积极结果。48周治疗数据显示,Stelara阳性对照组实现临床缓解的患者比例为58.7%,而Tremfya治疗组这一数值达到57.4%-73%,而且他们中大多数实现无皮质类固醇临床缓解(CDAI<150,第48周未接受皮质类固醇治疗)。Tremfya的安全性与已获批适应症中的Tremfya已知的安全性一致。
4.FIC二肽基肽酶抑制剂前列腺癌临床积极。BioXcel公司首创(first-in-class)二肽基肽酶口服小分子抑制剂BXCL701(talabostat)与PD-1疗法Keytruda联用,在治疗腺癌表型、晚期难治性转移性去势抵抗性前列腺癌患者的Ⅰb/Ⅱ期研究(NCT03910660)结果积极。中位随访12个月时,复合缓解率为23%(6/26),疾病控制率(DCR)为63%;而且联合治疗显示出可接受的耐受性。详细结果公布在ASCO GU2022会议上。
5.Moderna公布mRNA疫苗新布局。Moderna公司拓展mRNA管线并纳入三个新的疫苗(mRNA-1608、mRNA-1468和mRNA-4359)开发项目。mRNA-1608针对的是单纯疱疹病毒(HSV),拟开发用于治疗由HSV-1或HSV-2引起的生殖器疱疹。mRNA-1468针对的是水痘-带状疱疹病毒,拟用于成人预防免疫力下降导致的潜伏病毒重新激活。mRNA-4359靶向IDO与PD-L1抗原,旨在刺激效应T细胞,拟用于治疗晚期或转移性皮肤黑色素瘤,以及非小细胞肺癌。
6.PKU基因疗法遭FDA暂停临床。FDA叫停了Homology公司基因疗法HMI-102治疗苯丙酮尿症(PKU)的临床研究pheNIX,原因是需要修改该研究的风险缓解措施,以响应肝功能测试升高的观察结果。HMI-102是Homology公司研发的一项针对PKU的一次性基因疗法,旨在将功能性PAH基因拷贝递送至肝细胞,恢复苯丙氨酸(Phe)的正常代谢途径。此前,FDA已授予HMI-102孤儿药资格和快速通道资格。
医药热点
1.北京16项试管婴儿项目首进医保。2月21日,北京市医保局发文,规范调整本市公立医疗机构63项医疗服务价格项目,同时明确基本医疗保险和工伤保险报销政策。为实施积极生育支持措施,北京市医保局首次将门诊治疗中常见的宫腔内人工授精术、胚胎移植术、精子优选处理等16项辅助生殖技术项目纳入医保甲类报销范围。
2.社保基金行政监督办法出台。人力资源和社会保障部2月22日发布《社会保险基金行政监督办法》,自3月18日起施行。该办法拓展了监督范围,除了社保经办机构、服务机构,还将其他与社保基金收支管理直接相关的单位纳入监督范围;细化了违法情形并明确法律责任,打击骗保、套保或挪用贪占社保基金的违法行为。
评审动态
2. FDA新药获批情况(北美02月18日)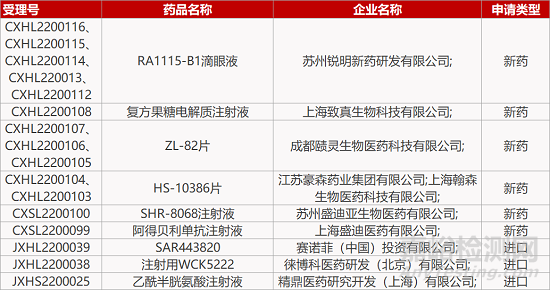
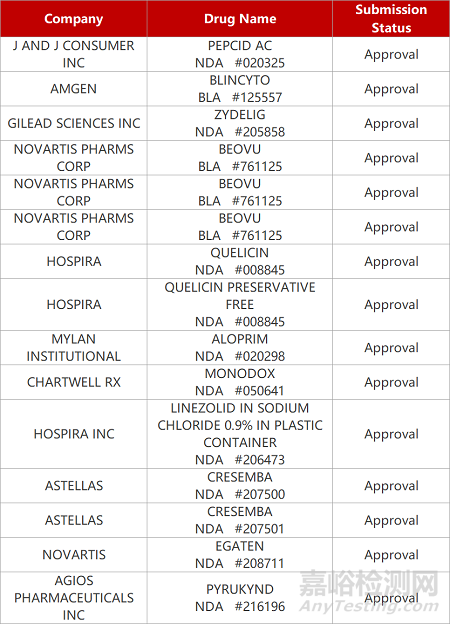

来源:药研发


