您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-03-21 12:05
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.贝达ALK抑制剂获批一线治疗NSCLC。贝达药业ALK抑制剂盐酸恩沙替尼胶囊新适应症获NMPA批准,用于一线治疗ALK阳性非小细胞肺癌(NSCLC)。在一项国际Ⅲ期临床(eXalt3)中,与克唑替尼组相比,恩沙替尼治疗组患者的中位PFS显著更高(31.3个月vs12.7个月),2年期总生存率达到78%。恩沙替尼是首款国产ALK抑制剂,此前已获批用于二线治疗ALK阳性局部晚期或转移性NSCLC患者。
2.礼来VEGFR-2单抗在华获批上市。礼来VEGFR-2抗体雷莫西尤单抗(ramucirumab)注射液获国家药监局批准上市,适应症推测为晚期胃癌二线治疗。在一项亚洲Ⅲ期临床RAINBOW-Asia中,与安慰剂相比,ramucirumab联合紫杉醇显著延长患者的中位无进展生存期(4.14个月vs3.15个月),中位总生存期与国际关键注册临床RAINBOW一致(HR=0.963)。去年9月,ramucirumab用于中国肝癌人群的Ⅲ期临床(REACH-2)也达到主要终点。
3.罗氏PD-L1在华获批辅助治疗NSCLC。NMPA批准罗氏PD-L1疗法阿替利珠单抗(泰圣奇® Tecentriq®)新适应症,单药用于检测评估为≥1%肿瘤细胞(TC)PD-L1染色阳性、经手术切除、以铂类为基础化疗之后的II-IIIA期非小细胞肺癌(NSCLC)患者的辅助治疗。这是中国获批的唯一一个NSCLC术后辅助免疫治疗适应症。该项适应症已于2021年10月15日获FDA批准并被写入了2021肺癌NCCN指南(第7版)。
4.诺诚健华CD19单抗国内报IND。诺诚健华与Incyte公司合作开发的CD19单抗「注射用Tafasitamab」的临床试验申请获CDE受理。这是国内第2款申报的CD19单抗,此次为首次申报临床。在美国,Tafasitamab已于2020年8月获批上市,联合来那度胺用于复发/难治性弥漫性大B细胞淋巴瘤(DLBCL)。除DLBCL适应症外,Tafasitamab目前还开发用于多种肿瘤领域适应症,进展最快为滤泡性淋巴瘤(FL)和边缘区淋巴瘤(MZL)。
5.先声布局高选择性JKA1抑制剂。先声药业宣布与凌科药业达成战略合作,获得后者新一代JAK1抑制剂LNK01001在中国境内合作适应症的独家商业化权益。LNK01001独特的分子设计使药物具有良好的安全性能。其GLP毒理实验中安全性部分指标甚至超过乌帕替尼。尚未出现任何和药物相关的不良反应。LNK01001目前已有3个适应症(类风湿关节炎、强直性脊柱炎、特应性皮炎)处于Ⅱ期临床开发阶段。
6.复宏汉霖2021年营收大增186.3%。3月16日,复宏汉霖公布2021年度业绩报告,实现营业收入约人民币16.825亿元,较去年同期增长约186.3%;亏损由2020年度的9.935亿元缩窄至9.841亿元;研发投入17.637亿元,销售费用5.203亿元。其中曲妥珠单抗(汉曲优®,Zercepac®)国内销售收入约8.680亿元,较2020年涨幅约692.7%,海外销售收入约6220万元,海外授权许可及研发服务收入约3020万元。
国际药讯
1.创新GABA别构调节剂获批上市。FDA批准Marinus Pharmaceuticals公司GABAA受体阳性别构调节剂Ztalmy(ganaxolone,加奈索酮)口服混悬剂上市,用于治疗与CDKL5缺乏症(CDD)相关的癫痫发作。在一项Ⅲ期临床中,与安慰剂组相比,ganaxolone治疗组第28天时患者主要运动癫痫发作频率显著降低(中位降幅:30.7%vs6.9%,p=0.0036)。这是获FDA批准针对这一患者群体的首款疗法,此前FDA已授予其孤儿药资格和罕见儿科疾病资格。
2. Keytruda辅助治疗肺癌Ⅲ期临床积极。默沙东PD-1抑制剂Keytruda用于辅助治疗IB-IIIA期非小细胞肺癌(NSCLC)的Ⅲ期临床结果积极。与安慰剂相比,Keytruda降低患者切除手术后的疾病复发或死亡风险24%([HR]=0.76 [95% CI,0.63-0.91];p=0.0014),并提高患者的中位DFS(53.6个月vs42.0个月)。但在PD-L1(TPS>50%)的患者中,Keytruda组的DFS改善未达到统计学显著性(HR=0.82 [95% CI, 0.57-1.18]; p=0.14)。目前,该项试验正在评估OS数据。
3.首款LAG-3抗体获FDA批准上市。百时美施贵宝LAG-3抗体relatlimab(Opdualag)获FDA批准上市,与PD-1抗体Opdivo联用治疗不可切除或转移性黑色素瘤。在一项Ⅱ/Ⅲ期临床中,与安慰剂相比,这一组合显著改善患者的PFS,两组的中位PFS分别为10.12个月(95% CI: 6.4-15.7)和4.63个月(95% CI: 3.4-5.6)。去年9月,FDA授予这一联合治疗优先审评资格。relatlimab也是首个获得FDA批准的LAG-3抗体。
4.血友病A基因疗法Ⅲ期成果见刊NEJM。BioMarin公司在《新英格兰医学杂志》上发表其基因疗法valoctocogene roxaparvovec治疗严重血友病A的的Ⅲ期临床研究成果。与入组前一年的数据相比,单次输注这款基因疗法4周后,患者的凝血因子VIII年使用率和需要接受治疗的年出血率(ABR)分别降低99%和84%(p<0.001);90%(121/134)的受试者没有需要治疗的出血事件,或者与接受因子VIII预防性治疗相比出血事件减少。
5.ASO疗法Ⅱ期结果登上NEJM。Ionis公司反义寡核苷酸(ASO)疗法donidalorsen(IONIS-PKK-LRx)治疗遗传性血管水肿(HAE)的Ⅱ期临床发表在《新英格兰医学杂志》上。与安慰剂相比,每月一次皮下注射donidalorsen使患者的HAE发作降低90%(P<0.001),两组每月HAE平均发作分别为0.23(95% CI,0.08~0.39)和2.21(95% CI,0.58~3.85)。并且donidalorsen组患者的生活质量也获得显著改善。此外,donidalorsen具有良好的安全性与耐受性特征。
6.安斯泰来更年期药物亚洲临床失败。安斯泰来NK3R拮抗剂fezolinetant治疗更年期女性中重度血管舒缩症状(VMS)的亚洲Ⅲ期试验MOONLIGHT 1未达到主要终点。与安慰剂相比,fezolinetant治疗组女性12周后VMS频率较基线水平有所改善,但不具统计学意义。fezolinetant的安全性数据与已知研究相一致。此前,该疗法已在治疗更年期相关VMS的两项关键Ⅲ期临床(SKYLIGHT1和SKYLIGHT2)中取得积极结果。
医药热点
1.武汉团队揭秘女性更易得AD原因。湖北省人民医院(武汉大学人民医院)神经内科熊婧博士及特聘教授叶克强团队在最新一期国际期刊《自然》在线发表研究论文《抑制卵泡刺激素的作用可以改善阿尔茨海默病小鼠的认知功能障碍》,全球首次揭示卵泡刺激素是老年女性更易患阿尔茨海默病的重要原因,为该病的早期筛查和干预提供新方案。
2.六部门推进家庭医生签约服务高质量发展。国家卫健委、财政部、人社部、国家医保局、国家中医药局、国家疾控局六部门日前联合印发相关指导意见,提出从2022年开始,各地在现有服务水平基础上,全人群和重点人群家庭医生签约服务覆盖率每年提升1至3个百分点;并将老年人、孕产妇、儿童、残疾人、脱贫人口、计划生育特殊家庭成员以及高血压、糖尿病、结核病和严重精神障碍患者等作为签约服务重点人群,优先签约、优先服务。
3.重庆新冠抗原检测医院收费15元/人次封顶。3月17日,重庆市医保局印发《关于制定新型冠状病毒抗原检测项目价格的通知》。重庆市新增新冠病毒抗原检测价格项目将采取“技耗分离”的方式,公立医疗机构按照“检测价格项目+检测试剂”的方式收费。新冠病毒抗原检测项目政府指导价5元/人次,公立医疗机构收费不得上浮。“检测价格项目+检测试剂”费用总和超过15元/人次的,实际收费按照15元/人次封顶。
4.福建:中药配方颗粒可报销70%。3月14日,福建省医保局印发通知明确,在福建省上市备案、跨省销售备案,以及2021年11月1日按福建省执行标准生产的中药配方颗粒,按全国省级挂网最低价实行价格联动。此项政策基本囊括该省公立医院销售的中药配方颗粒品种,相当于把配方颗粒品类纳入医保范围。按照规定,中药配方颗粒按照销售价格70%报销。而限定支付范围则按照中药饮片的标准执行,而且保留中药饮片院内销售有15%加成的权益。
评审动态
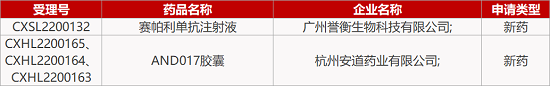
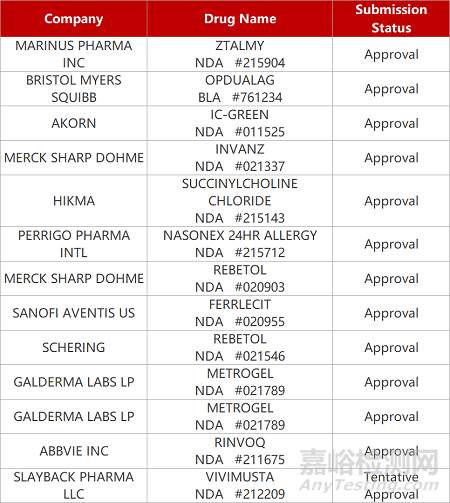
1. CDE新药受理情况(03月18日)

来源:药研发